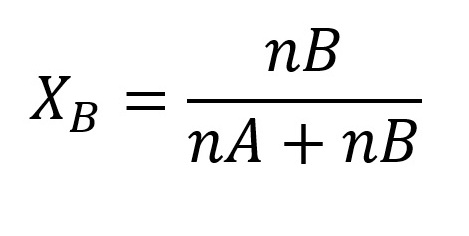Sifat koligatif larutan adalah sifat larutan yang bergantung pada banyaknya zat terlarut dan tidak tergantung pada jenis zat terlarut. Sifat-sifat koligatif larutan dibagi menjadi empat bagian, yaitu penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
1. Penurunan Tekanan Uap (∆P)
Pada tahun 1880-an seorang ahli kimia Prancis bernama F.M. Rault, menyatakan bahwa melarutkan zat terlarut mempunyai efek menurunkan tekanan uap dari pelarut. Hukum Roult tersebut dapat dirumuskan sebagai berikut.
∆P = P0 . XB
Keterangan:
∆P = Penurunan tekanan uap jenuh pelarut
P0 = Tekanan uap pelarut murni
XB = Fraksi mol zat terlarut
Fraksi mol zat terlarut atau XB dapat dicari menggunakan rumus:
Di mana,
nB = Mol zat terlarut
nA = Mol zat pelarut
Jika dalam larutan hanya terdapat satu zat terlarut, maka XB = 1-XA, di mana XA adalah fraksi mol zat pelarut. Dengan demikian dapat dituliskan sebagai berikut.
∆P = P0 . XB
P0 – P = (1 – XA) . P0A
P0 – P = P0A – XA . P0A
P = XA . P0A
2. Kenaikan Titik Didih (∆Tb)
Titik didih larutan ialah suhu pada saat tekanan uap larutan sama dengan tekanan atmosfer luar. Karena pada suhu berapapun tekanan uap larutan lebih rendah daripada tekanan uap pelarut murninya, menyebabkan titik didih larutan lebih tinggi daripada titik didih pelarut murni.
Selisih antara titik didih (Tb) suatu larutan dengan titik didih (Tb) pelarut murni disebut kenaikan titik didih larutan (∆Tb) .
∆Tb = Tb larutan – Tb pelarut
Kenaikan titik didih berbanding lurus dengan molalitas (m) zat terlarut di dalamnya. Sehingga kenaikan titik didih dapat dirumuskan sebagai.
∆Tb = m.Tb
3. Penurunan Titik Beku (∆Tf)

Penurunan titik beku (∆Tf) adalah selisih temperatur titik beku (Tf) larutan dengan titik beku (Tf) pelarut murni. Berdasarkan diagram fasa di atas, dapat dilihat bahwa tekanan uap larutan lebih rendah daripada tekanan uap pelarut murni. Hal ini menyebabkan penurunan titik beku larutan lebih rendah dibandingkan dengan penurunan titik beku pelarut murni. Persamaan penurunan titik beku didefinisikan sebagai berikut.
∆Tf = Tf larutan – Tf pelarut
Penurunan titik beku berbanding lurus dengan molalitas (m) zat terlarut di dalamnya. Sehingga dapat dirumuskan sebagai berikut.
∆Tf = m.Tf
4. Tekanan Osmotik (π)

Tekanan osmotik adalah gerakan bersih molekul pelarut melewati membrane semi-permeable dari pelarut murni atau dari larutan encer ke larutan yang lebih pekat. Tekanan osmotik larutan dinyatakan sebagai
π = M.R.T
Dimana M adalah molaritas larutan, R adalah konstanta gas (0,0821 L.atm/K.mol), dan T adalah suhu mutlak. Tekanan osmotik (π) dinyatakan dalam atmosfer (atm). Karena pengukuran tekanan osmotik dilakukan pada suhu tetap, kita menyatakan konsentrasi di sini dengan satuan yang lebih mudah, yaitu molaritas, bukan molalitas. Seperti halnya kenaikan titik didih dan penurunan titik beku, tekanan osmotik juga berbanding lurus dengan konsentrasi larutan.
Untuk lebih memahami sifat-sifat koligatif larutan. Mari kita simak Contoh Soal Sifat Koligatif Larutan.
Pelajari Juga: