Entalpi pembakaran standar adalah perubahan entalpi untuk membakar setiap mol suatu zat yang diukur pada suhu 250C dan tekanan 1 atm. Reaksi pembakaran selalu melibatkan gas oksigen (O2) dan gas karbon dioksida untuk pembakaran sempurna atau gas karbon monoksida untuk pembakaran tidak sempurna. Perhatikan contoh soal entalpi pembakaran dan pembahasannya berikut ini supaya kamu lebih paham lagi.
Soal No. 1
Pada pembakaran 570 gram isooktana (C8H18), salah satu komponen yang ada dalam bensin, pada keadaan standar/STP dibebaskan kalor sebesar 27.500 kJ. Hitunglah besarnya entalpi pembakaran standar dan tulislah persamaan termokimia pembakaran isooktana tersebut!
Pembahasan:
Jumlah mol C8H8 = gr/Mr = 570/115 = 5 mol
∆H0c 1 mol C8H18 = ⅕ x (-27.500) = -5.500 kJ
Persamaan termokimia:
C8H18(l) + 12 ½ O2(g) → 8CO2(g) + 9H2O(g) ∆H0c = -5.500 kJ/mol
Soal No. 2
Pada pembekaran 1 gram karbon (Ar C = 12) dibebaskan kalor sebesar 85 kJ. Tuliskan persamaan termokimia pembakaran sempurna karbon!
Pembahasan:
Jumlah mol C = gr/Ar = 1/12 mol.
Persamaan termokimia pembakaran sempurna karbon:
C + O2 → CO2 ∆H = -85 kJ/mol
Soal No. 3
Diketahui entalpi pembentukan:
CO2(g) = -393,5 kJ/mol; H2O(g) = -242 kJ/mol dan C3H8(g) = -104 kJ/mol.
Tentukan entalpi pembakaran propane membentuk gas CO2(g) dan air!
Pembahasan:
Reaksi pembakaran propane:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(g)
∆HReaksi = ∆H produk – ∆H reaktan
∆HReaksi = [(3 x ∆H CO2) + (4 x ∆H H2O)] – [(∆H C3H8) + (5 x ∆H O2)]
∆HReaksi = [(3 x -393,5) + (4 x -242)] – [(-104) + (5 x 0)]
∆HReaksi = -1.180,5 – 968 + 104 = -2.044,5 kJ/mol
Soal No. 4
Hitung ∆H pembakaran 116 gram gas butana jika diketahui:
∆H0f C4H10(g) = -126,5 kJ/mol
∆H0f CO2(g) = -393,5 kJ/mol
∆H0f H2O(l) = -285,8 kJ/mol
Pembahasan:
Persamaan reaksi pembakaran gas butana:
C4H10 + 6 ½ O2 → 4CO2 + 5H2O
∆HReaksi = ∆H produk – ∆H reaktan
∆HReaksi = [(4 x ∆H CO2) + (5 x ∆H H2O)] – [(∆H C4H10) + (6 ½ x ∆H O2)]
∆HReaksi = [(4 x -393,5) + (5 x -285,8)] – [(-126,5) + (6 ½ x 0)]
∆HReaksi = -1.574 – 1.429 + 126,5 = -2.876,5 kJ/mol
Soal No. 5
Tuliskan persamaan termokimia untuk pembakaran 1 mol etanol (C2H5OH) secara sempurna dibebaskan kalor sebanyak 1364 kJ.
Pembahasan:
Persamaan termokimia untuk pembakaran 1 mol etanol:
C2H5OH + 3O2 → 2CO2 + 3H2O ∆H = -1364 kJ
Soal No. 6
Diketahui entalpi pembakaran methanol, CH4OH(l) = -238,6 kJ/mol; CO2(g) = -393,5 kJ/mol; dan H2O(l) = -286 kJ/mol.
- Tentukan entalpi pembakaran methanol membentuk gas CO2(g) dan air!
- Tentukan jumlah kalor yang dibebaskan pada pembakaran 8 gram methanol. (Ar H = 1; C = 12; O = 16).
Pembahasan:
Reaksi pembakaran methanol:
CH4O(l) + 3/2 O2(g) → CO2(g) + 2H2O(g)
1. Entalpi pembakaran methanol:
∆HReaksi = ∆H produk – ∆H reaktan
∆HReaksi = [∆H CO2 + (2 x ∆H H2O)] – [(∆H CH4O) + (3/2 x ∆H O2)]
∆HReaksi = [-393,5 + (2 x -286)] – [-238,6 + (3/2 x 0)]
∆HReaksi = -393,5 – 572 + 238,6 = -726,9 kJ/mol
2. Jumlah kalor yang dibebaskan pada pembakaran 8 gram methanol
jumlah mol methanol = gr/Mr = 8/32 = 0,25 mol
∆H = jumlah mol x ∆HReaksi
∆H = 0,25 x -2.876,5 = -181,725 kJ/mol
Soal No. 7
Diketahui:
∆H0f C6H6(g) = 83 kJ/mol
∆H0f CO2(g) = 394 kJ/mol
∆H0f H2O(l) = 286 kJ/mol
Hitung ∆H pembakaran 1 mol C6H6!
Pembahasan:
Reaksi pembakaran 1 mol C6H6:
C6H6(g) + 7 ½ O2(g) → 6CO2(g) + 3H2O(l)
∆H pembakaran 1 mol C6H6
∆HReaksi = ∆H produk – ∆H reaktan
∆HReaksi = [(6 x ∆H CO2 + (3 x ∆H H2O)] – [(∆H C6H6) + (7 ½ x ∆H O2)]
∆HReaksi = [(6 x 394) + (3 x 286)] – [83 + (7 ½ x 0)]
∆HReaksi = 2364 + 858 – 83 = +3139 kJ/mol
Soal No. 8
Pada reaksi pembakaran etanol dihasilkan gas karbon dioksida dan air. Berdasarkan data energi ikatan, tentukan kalor pembakaran etanol.
C2H5OH(aq) + 3O2(g) → 2CO2(g) + 3H2O(l)
Pembahasan:
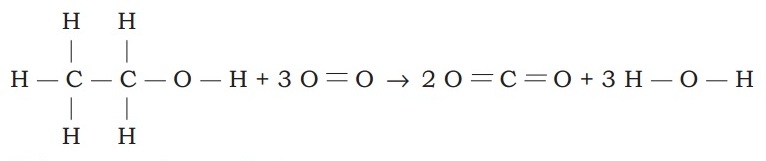
Soal No. 9
Sebanyak 2 gram naftalena (C10H8), zat yang berbau tajam dan biasa digunakan untuk mengusir ngengat, dibakar dalam kalorimeter bom. Dari hasil pengamatan, suhu air dalam kalorimeter naik sebesar 50C. Jika kapasitas kalor kalorimeter adalah 10,17 kJ/0C, tentukanlah perubahan entalpi pada reaksi tersebut!
Pembahasan:
Q reaksi = -Q kalorimeter
Q reaksi = -(C x ∆T)
Q reaksi = -(10,17 x 5) = – 50,85 kJ
Jumlah mol naftalen = gr/Mr = 2/128 = 0,015 mol
∆Hreaksi = 1/0,015 x (-50,58) = 3.390 kJ/mol
Soal No. 10
Benzena (C6H6) terbakar diudara dan menghasilkan karbon dioksida dan air cair. Berapakah panas yang dilepaskan per mol oleh pembakaran benzene? Entalpi pembentukan standar benzene adalah 49,04 kJ/mol. ∆H0f CO2 = -393,5 kJ/mol; ∆H0f H2O = -187,6 kJ/mol.
Pembahasan:
Persamaan reaksi pembakaran benzene
C6H6(l) + 7 ½O2(g) → 6CO2(g) + 3H2O(l)
Perubahan entalpi:
∆HReaksi = ∆H produk – ∆H reaktan
∆HReaksi = [(6 x ∆H CO2 + (3 x ∆H H2O)] – [(∆H C6H6) + (7 ½ x ∆H O2)]
∆HReaksi = [(6 x -393,5) + (3 x -187,6)] – [49,04 + (7 ½ x 0)]
∆HReaksi = -2361 – 562,8 – 49,04 = -2972,84 kJ/mol
Q = -∆HReaksi = -(-2972,84 kJ/mol) = +2972,84 kJ/mol

DOMAIN SERVICES EXPIRATION NOTICE FOR materikimia.com
Domain Notice Expiry ON: Jan 19, 2021
We have actually not received a settlement from you.
We’ve tried to email you yet were unable to contact you.
Browse Through: https://bit.ly/35PhB6w
For info and to post a discretionary settlement for your domain website service.
011920210041363753688578798materikimia.com