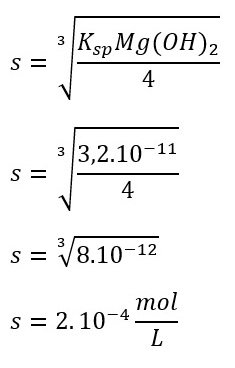Contoh Soal Kelarutan dan Hasil Kali Kelarutan No.6-10
Soal No. 6
Jika kelarutan garam perak sulfat dalam air murni adalah 1,5.10-5 M, tentukan hasil kali kelarutan garam tersebut!
Pembahan
Diketahui:
s Ag2SO4 = 1,5 . 10-5
Ditanya: Ksp …?
Jawab:
Reaksi : Ag2SO4(s) ⇌ 2Ag+(aq) + SO42-(aq)
Kelarutan : 1,5 . 10-5 3 . 10-5 1,5 . 10-5
Ksp = [Ag+]2[SO42-]
Ksp = (3.10-5)2 (1,5.10-50
Ksp = 1,35.10-14
Jadi, tentukan hasil kali kelarutan Ag2SO4 sebesar 1,35 . 10-14.
Soal No. 7
Tuliskan tetapan hasil kali kelarutan (Ksp) untuk larutan Al(OH)3 jenuh.
Pembahasan
Reaksi: Al(OH)3(s) ⇌ Al3+(aq) + 3OH–(aq)
Ksp = [Al3+] [OH–]3
Soal No. 8
Hitung kelarutan dari larutan jenuh AgBr jika diketahui Ksp AgBr = 5,0 . 10-13.
Pembahasan
Diketahui:
Ksp AgBr = 5,0 . 10-13
Ditanya: s …?
Jawab:
Reaksi : AgBr(s) ⇌ Ag+(aq) + Br–(aq)
Kelarutan : s s s
Ksp = [Ag+] [Br–]
Ksp = (s) (s)
Ksp = s2
s = √Ksp
s = √5.10-13
s = 6,33.10-6 mol/L
Jadi, kelarutan larutan jenuh AgBr sebesar 6,33 . 10-6 mol/L.
Soal No. 9
Larutan jenuh senyawa hidroksida suatu logam M(OH)3 mempunyai pH = 9. Maka harga Ksp M(OH)3 adalah…
Pembahasan
Diketahui
pH = 9
Ditanya: Ksp M(OH)3 …?
Jawab:
pH = 14 – pOH
9 = 14 – pOH
pOH = 14 – 9 = 5
pOH = -log [OH–]
5 = -log [OH–]
[OH–] = 10-5
Reaksi : M(OH)3(s) ⇌ M+(aq) + 3OH–(aq)
Kelarutan : 10-5 10-5 3 . 10-5
Ksp = [M3+][OH–]3
Ksp = (10-5)(3.10-15)
Ksp = 3.10-20
Jadi, harga Ksp M(OH)3 sebesar 3 . 10-20.
Soal No. 10
Jika Ksp Mg(OH)2 = 3,2 . 10-11 maka larutan jenuh Mg(OH)2 mempunyai pH sebesar ….
Pembahasan
Diketahui: Ksp Mg(OH)2 = 3,2 . 10-11
Ditanya : pH Mg(OH)2 …?
Jawab:
Reaksi : Mg(OH2(s) ⇌ Mg2+(aq) + 2OH–(aq)
Kelarutan : s s 2s
Ksp = [Mg2+][OH–]2
Ksp = (s) (2s)2
Ksp = 4s3
[OH–] = 2s
[OH–] = 2 (2.10-4)
[OH–] = 4.10-4
pOH = -log [OH–]
pOH = -log 4.10-4
pOH = 4-log4
pH = 14 – pOH
pH = 14 – 4 – log 4 = 10 – log 4
Jadi, pH larutan jenuh Mg(OH)2 sebesar 10 – log 4.