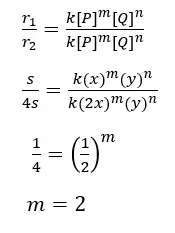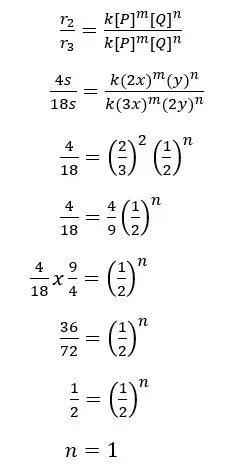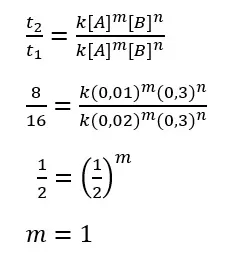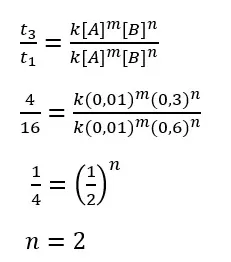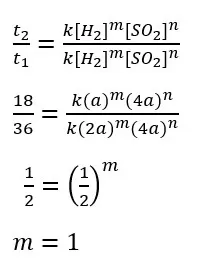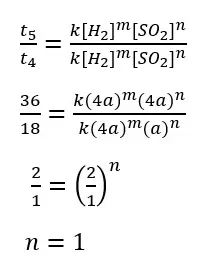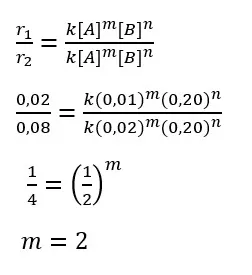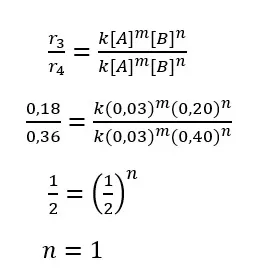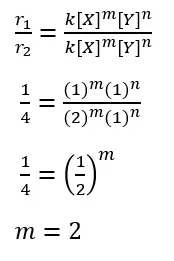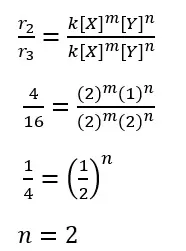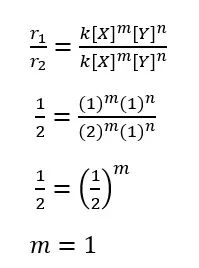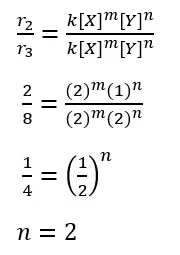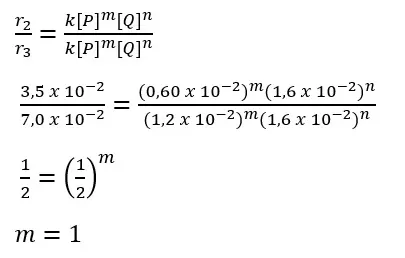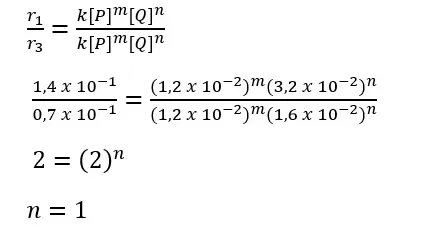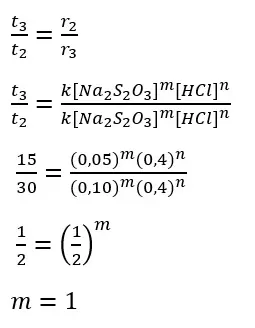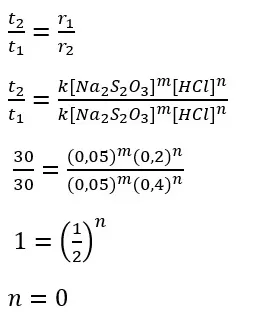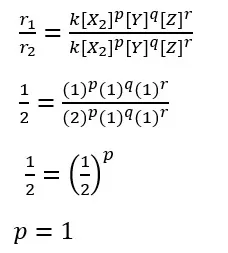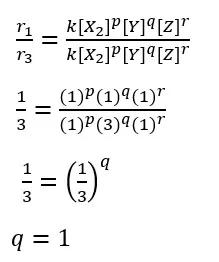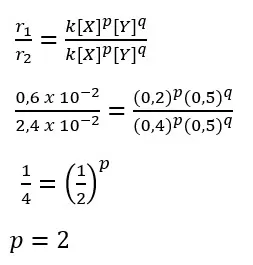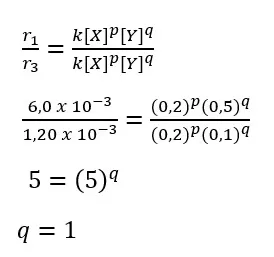Berikut ini contoh soal persamaan laju reaksi yang disertai dengan pembahasannya secara lengkap. Contoh soal persamaan laju reaksi ini juga dapat dijadikan sebagai bahan latihan soal persamaan laju reaksi.
Soal No. 1
Pada reaksi 2P + 2Q → R + 2S diperoleh data sebagai berikut.
| [P] (M) | [Q] (M) | Laju Reaksi (M/detik) |
| x | y | s |
| 2x | y | 4s |
| 3x | 2y | 18s |
Berdasarkan data tersebut maka persamaan laju reaksinya adalah …..
A. r = k [P][Q]
B. r = k[P]2[Q]2
C. r = k[P]2[Q]
D. r = k[P][Q]2
E. r = k[P][Q]1/2
Jawaban: C
Pembahasan:
Kita tentukan terlebih dahulu orde reaksi terhadap P dengan hasil percobaan 1 dan 2.
Selanjutnya kita tentukan orde reaksi terhadap Q dengan hasil percobaan 2 dan 3.
Sehingga dihasilkan persamaan laju reaksi sebagai berikut.
r = k [P]2[Q]
Soal No. 2
Pada reaksi 2A + B → 2C, didapat data laju reaksi sebagai berikut.
| No. | [A] (mol/L) | [B] (mol/L) | Waktu (detik) |
| 1 | 0,01 | 0,3 | 16 |
| 2 | 0,02 | 0,3 | 8 |
| 3 | 0,01 | 0,6 | 4 |
Persamaan laju reaksi yang sesuai dengan data tersebut adalah ….
A. r = k [A]
B. r = k [A] [B]
C. r = k [A]2[B]
D. r = k [A] [B]2
E. r = k [A]2[B]2
Jawaban: D
Pembahasan:
Kita cari orde reaksi A dengan hasil percobaan 1 dan 2.
Selanjutnya kita cari orde reaksi B dengan percobaan 1 dan 3.
Sehingga dihasilkan persamaan laju reaksi sebagai berikut.
r = k [A] [B]2
Soal No. 3
Perhatikan data-data percobaan berikut:
| Percobaan | [H2] mol/L | [SO2] mol/L | Waktu reaksi (detik) |
| 1 | a | 4a | 36 |
| 2 | 2a | a | 18 |
| 3 | 4a | 4a | 9 |
| 4 | 4a | 2a | 18 |
| 5 | 4a | a | 36 |
Pernyataan yang sesuai dengan data tersebut adalah ….
A. Orde reaksi terhadap H2 adalah 2
B. Orde reaksi terhadap SO2 adalah 2
C. Orde reaksi total adalah 4
D. Kecepatan reaksi menjadi 4 kali jika [H2] dan [SO2] dinaikkan dua kali
E. Rumus laju reaksi: v = k [H2]2[SO]2
Jawaban: D
Pembahasan:
Kita cari terlebih dahulu orde reaksi masing-masing zat. Pertama kita tentukan orde reaksi [H2] dengan membandingkan data percobaan 1 dan 2.
Selanjutnya kita cari orde reaksi [SO2] dengan mmbandingkan data percobaan 4 dan 5.
Orde reaksi total = m + n = 1 + 1 = 2
Persamaan laju reaksi:
r = k [H2][SO2]
Dari hasil perhitungan tersebut dapat disimpulkan bahwa hanya pilihan D yang benar.
Soal No. 4
Data percobaan laju reaksi diperoleh dari reaksi: A + B → C, sebagai berikut:
| Percobaan | [A] molar | [B] molar | Laju reaksi (molar/detik) |
| 1 | 0,01 | 0,20 | 0,02 |
| 2 | 0,02 | 0,20 | 0,08 |
| 3 | 0,03 | 0,20 | 0,18 |
| 4 | 0,03 | 0,40 | 0,36 |
Rumus laju reaksinya adalah ….
A. r = k [A]2[B]
B. r = k [A][B]2
C. r = k [A][B]
D. r = k [A]2[B]2
E. r = k [A]3[B]
Jawaban: A
Pembahasan:
Persamaan laju reaksi:
r = k [A]2 [B]
Soal No. 5
Terdapat suatu reaksi X + Y → XY. Jika molaritas X dinaikan 2 kali dan molaritas Y tetap, maka laju reaksi 4 kali lebih besar. Jika molaritas X dan Y dinaikan 2 kali, maka laju reaksi menjadi 16 kali lebih besar. Persamaan laju reaksi tersebut adalah ….
A. r = k [X]²
B. r = k [X]²[Y]³
C. r = k [X][Y]²
D. r = k [X][Y]
E. r = k [X]²[Y]²
Jawaban: E
Pembahasan:
Jika kita tuliskan dalam bentuk tabel, maka hasil percobaannya adalah sebagai berikut.
| Percobaan | [X] (M) | [Y] (M) | Laju reaksi (M/detik) |
| 1 | 1 | 1 | 1 |
| 2 | 2 | 1 | 4 |
| 3 | 2 | 2 | 16 |
Selanjutnya dapat kita cari masing-masing orde reaksi X dan Y.
Sehingga dihasilkan orde reaksi X dan Y adalah 2. Itu artinya, persamaan laju reaksi pada reaksi di atas adalah sebagai berikut.
r = k [X]²[Y]²
Soal No. 6
Untuk reaksi: A + B → zat hasil, bila diketahui:
a. Konsentrasi awal A dinaikkan 2 kali lipat pada konsentrasi B yang tetap, maka laju reaksi menjadi dua kali lebih besar.
b. Konsentrasi awal A dan B masing-masing dinaikkan 2 kali lipat, maka reaksi menjadi 8 kali lebih besar.
Maka rumusan persamaan laju reaksinya adalah …
A. r = k [A]
B. r = k [A][B]
C. r = k [A]2
D. r = k [A][B]2
E. r = k [A]2[B]
Jawaban: D
Pembahasan:
Kita tuliskan dulu hasil percobaannya dalam bentuk tabel
| Percobaan | [A] (M) | [B] (M) | Laju reaksi (M/detik) |
| 1 | 1 | 1 | 1 |
| 2 | 2 | 1 | 2 |
| 3 | 2 | 2 | 8 |
Selanjutnya kita hitung orde reaksi A dan orde reaksi B dengan data percobaan diatas.
Setelah ditemukan orde reaksi masing-masing reaktan maka dapat kita tuliskan rumusan persamaan laju reaksinya.
r = k [A][B]2
Soal No. 7
Pada reaksi P + Q → R diperoleh data:
| Percobaan | [P] (M) | [Q] (M) | Laju reaksi (M/detik) |
| 1 | 1,2 x 10-2 | 3,2 x 10-2 | 1,4 x 10-1 |
| 2 | 6,0 x 10-3 | 1,6 x 10-2 | 3,5 x 10-2 |
| 3 | 1,2 x 10-2 | 1,6 x 10-2 | 7,0 x 10-2 |
Rumusan laju reaksinya adalah ….
A. r = k [P] [Q] [R]
B. r = k [P]2 [Q] [R]
C. r = k [P]2 [R]
D. r = k [P] [Q]2 [R]
E. r = k [P] [R]2
Jawaban: A
Pembahasan:
Rumus laju reaksinya: r = k [P] [Q] [R]
Soal No. 8
Berikut ini adalah data hasil percobaan untuk menentukan hubungan antara konsentrasi awal pereaksi terhadap laju reaksi dari:
Na2S2O3(aq) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + SO2(g) + S(s)
Laju reaksi diukur berdasarkan waktu yang diperlukan untuk mendapatkan sejumlah endapan belerang yang sama. Hasil yang diperoleh adalah sebagai berikut.
| Percobaan | [Na2S2O3] (M) | [HCl] (M) | Waktu untuk mendapatkan 1 mol S (detik) |
| 1 | 0,05 | 0,2 | 30 |
| 2 | 0,05 | 0,4 | 30 |
| 3 | 0,10 | 0,4 | 15 |
| 4 | 0,10 | 0,8 | 15 |
- Tentukan orde reaksi terhadap Na2S2O3 dan terhadap HCl
- Tuliskan persamaan laju reaksinya.
Pembahasan:
Orde reaksi terhadap Na2S2O3
Orde reaksi terhadap HCl
Persamaan laju reaksi
r = k [Na2S2O3]
Soal No. 9
Untuk reaksi: X2 + Y + Z → XY + XZ, didapatkan data bahwa pada saat konsentrasi X2 diduakalikan dengan Y dan Z tetap, laju reaksi menjadi dua kali lebih cepat, dan pada konsentrasi X dan Z tetap dengan Y ditigakalikan, laju reaksinya juga menjadi tiga kali lebih cepat. Tetapi, perubahan konsentrasi Z pada X dan Y tetap tidak berpengaruh terhadap laju reaksi. Tentukan orde reaksi dan persamaan laju reaksinya.
Pembahasan:
Kita tuliskan hasil percobaan tersebut dalam sebuah tabel sehingga diperoleh data sebagai berikut.
| [X2] | [Y] | [Z] | Laju reaksi |
| 1 | 1 | 1 | 1 |
| 2 | 1 | 1 | 2 |
| 1 | 3 | 1 | 3 |
Selanjutnya dapat kita hitung masing-masing orde reaksi terhadap X, Y, dan Z.
Dengan menggunakan data percobaan 1 dan 2 kita dapat menghitung nilai orde reaksi terhadap X.
Kemudian dengan menggunakan data percobaan 1 dan 3 kita hitung orde reaksi terhadap Y
Karena konsentrasi Z tidak mempengaruhi laju reaksi maka orde reaksi terhadap Z adalah 0. Sehingga didapatkan persamaan laju reaksinya sebagai berikut.
r = k [X2][Y]
Soal No. 10
Pada reaksi: 2X(aq) + Y(aq) → Z(aq) diperoleh data percobaan sebagai berikut.
| [X] (mol L-1) | [Y] (mol L-1) | Laju reaksi (mol L-1 detik-1) |
| 0,2 | 0,5 | 6,0 x 10-3 |
| 0,4 | 0,5 | 2,4 x 10-2 |
| 0,2 | 0,1 | 1,20 x 10-3 |
| 0,3 | 0,4 | x |
Tentukan:
- Orde reaksi total
- Rumus laju reaksi
- Nilai tetapan laju reaksi (k) dan satuannya
- Nilai x
Pembahasan:
1. Orde reaksi total
2. Rumus laju reaksi
r = k [X]2[Y]
3. Nilai tetapan laju reaksi (k) dan satuannya
Dengan menggunakan data pertama kita dapat menghitung nilai tetapan laju reaksinya.
r = k [X]2[Y]
6,0 x 10-3 M/s = k (0,2 M)2 (0,5 M)
6,0 x 10-3 M/s = k 0,04 M2 . 0,5 M
6,0 x 10-3 M/s = k 0,02 M3
k . 2 x 10-2 M3 = 6,0 x 10-3 M/s
k = 6,0 x 10-3 M/s : 2 x 10-2 M3
k = 3 x 10-1 M-2 s-1
k = 0,3 M-2 s-1
4. Nilai x
r = k [X]2[Y]
r = 0,3 . (0,3)2 . (0,4)
r = 0,0108
r = 1,08 x 10-2