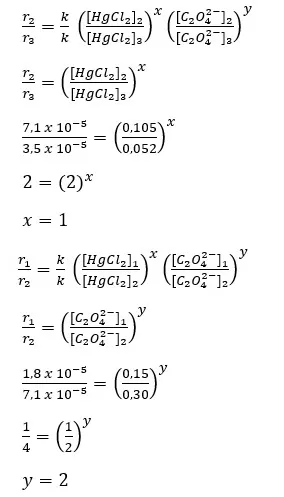Soal No. 1
Apa yang dimaksud dengan laju reaksi dan apa satuan dari laju reaksi?
Pembahasan:
Laju reaksi adalah berkurangnya jumlah pereaksi untuk tiap satuan waktu atauu bertambahnya jumlah hasil reaksi untuk tiap satuan waktu. Satuan laju reaksi umumnya dinyatakan dalam satuan mol/liter detik.
Soal No. 2
Apabila Anda diminta untuk mengukur laju terhadap reaksi:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Bagaimanakah rancangan percobaan yang akan Anda buat terkait dengan:
- Zat yang akan diukur konsentrasinya
- Cara mengukurnya
- Alat yang digunakan
- Cara kerjanya
Pembahasan:
- Zat yang akan diukur konsentrasinya yaitu gas H2
- Cara mengukurnya dengan menghitung volume gas H2 yang dihasilkan per satuan waktu
- Alat yang digunakan yaitu tabung reaksi, erlenmeyer, sumbat berlubang, silinder ukur 50 mL, arloji (stopwatch) dan gelas kimia 1 liter.
- Cara kerjanya: disiapkan larutan HCl dan logam Zn dalam tabung reaksi. Laju reaksi dapat diamati dari pelepasan gas yaitu terjadinya gelembung udara dan waktu yang diperlukan untuk menghabiskan logam Zn. Tabung reaksi diamati waktu yang dibutuhkan sampai logam habis. Hitung laju reaksinya dan urutkan besarnya laju reaksi dari yang terbesar ke yang lebih kecil. Masukkan hasil dalam lembar kerja.
Soal No. 3
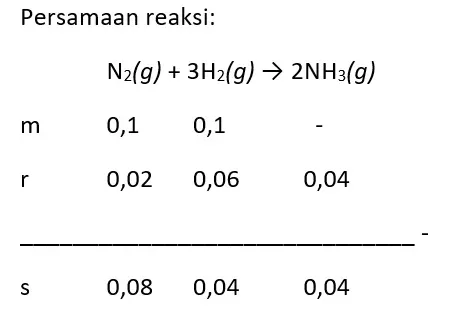
Ke dalam ruangan yang volumenya 10 liter direaksikan 0,1 mol gas N2 dan 0,1 mol gas H2 dengan persamaan reaksi berikut.
N2(g) + 3H2(g) → 2NH3(g)
Setelah reaksi berlangsung selama 5 detik, ternyata masih tersisa 0,08 mol gas N2. Tentukan laju reaksi sesaat berdasarkan:
- Gas nitrogen yang bereaksi (r N2)
- Gas hidrogen yang bereaksi (r H2)
- Gas NH3 yang terbentuk (r NH3)
Pembahasan:
[N2] = 0,02 mol/10 L = 0,002 M
[H2] = 0,06 mol/10 L = 0,006 M
[NH3] = 0,04 mol/10 L = 0,004 M
1. Gas nitrogen yang bereaksi (r N2)
r N2 = [N2]/t = 0,002 M/5 s = 4 x 10-4 M/s
2. Gas hidrogen yang bereaksi (r H2)
r H2 = [H2]/t = 0,006 M/5 s = 1,2 x 10-3 M/s
3. Gas NH3 yang terbentuk (r NH3)
r NH3 = [NH3]/t = 0,004 M/5 s = 8 x 10-4 M/s
Soal No. 4
Penentuan laju reaksi: 2A(g) + 3B2(g) → 2AB3(g), dilakukan dengan mengukur perubahan konsentrasi A setiap 5 detik sehingga didapatkan data sebagai berikut.
| Waktu (detik) | 0 | 5 | 10 |
| [A] (mol/L) | 0,1 | 0,08 | 0,065 |
Tentukan:
- Laju reaksi rata-rata gas A pada setiap selang waktu
- Laju reaksi rata-rata tiap selang waktu berdasarkan gas AB3 yang dihasilkan
Pembahasan:
1. Laju reaksi rata-rata gas A pada setiap selang waktu
Selang waktu 0 – 5 detik
r = [A]/t = (0,1 – 0,08)/ (5 – 0) = 4 x 10-3 M/s
Selang waktu 5 – 10 detik
r = [A]/t = (0,8 – 0,065)/(10 – 5) = 3 x 10-3 M/s
Selang waktu 0 – 10 detik
r = [A]/t = (0,1 – 0,065)/(10 – 0) = 35 x 10-3 M/s
2. Laju reaksi rata-rata tiap selang waktu berdasarkan gas AB3 yang dihasilkan
Selang waktu 0 – 5 detik
r = (koefisien AB3/koefisien A) x r A = (2/2) x 4 x 10-3 M/s = 4 x 10-3 M/s
Selang waktu 5 – 10 detik
r = (koefisien AB3/koefisien A) x r A = (2/2) x 3 x 10-3 M/s = 3 x 10-3 M/s
Selang waktu 0 – 10 detik
r = (koefisien AB3/koefisien A) x r A = (2/2) x 35 x 10-3 M/s = 35 x 10-3 M/s
Soal No. 5
Laju reaksi pada reaksi: 4NO2(g) + O2(g) → 2N2O5(g) diukur berdasarkan berkurangnya konsentrasi gas oksigen setiap detik. Jika pada suhu tertentu laju reaksinya adalah 0,024 mol/L detik, hitunglah laju reaksi jika diukur berdasarkan:
- Berkurangnya gas NO2 tiap detik
- Bertambahnya gas N2O5 tiap detik
Pembahasan:
Persamaan reaksi:
4NO2(g) + O2(g) → 2N2O5(g)
1. Berkurangnya gas NO2 tiap detik
r = (koefisien O2/koefisien NO2) x r NO2
0,024 = ¼ x r NO2
r NO2 = 0,024 x 4 = 0,096 M/s
2. Bertambahnya gas N2O5 tiap detik
r = (koefisien O2/koefisien N2O5) x r N2O5
0,024 = ½ x r N2O5
r N2O5 = 0,024 x 2 = 0,048 M/s
Soal No. 6
Mengapa laju reaksi banyak ditentukan dengan menggunakan konsentrasi awal reaksi pereaksi?
Pembahasan:
Karena pada saat reaksi berlangsung konsentrasi zat pereaksi akan menurun sehingga tidak dapat ditentukan konsentrasi pada saat reaksi berlangsung dan ada kemungkinan reaksi berbalik arah.
Soal No. 7
Jika reaksi A → B merupakan reaksi orde ke-0, tuliskan persamaan laju reaksinya dan tentukan satuan tetapan laju reaksinya.
Pembahasan:
Persamaan laju reaksinya:
r = k [A]0
atau
r = k
Satuan tetapan laju reaksinya yaitu M/s atau mol/L.detik
Soal No. 8
Persamaan laju reaksi untuk:
NH4+(aq) + NO2–(aq) → N2(g) + 2H2O(l)
Adalah r = k [NH4+][NO2–]. Pada suhu 250C, nilai k = 3,0 x 10-4 mol-1L detik-1. Hitunglah laju reaksinya jika [NH4+] = 0,25 M dan [NO2–] = 0,02 M.
Pembahasan:
r = k [NH4+] [NO2–]
r = 3 x 10-4 . (0,25) (0,02)
r = 3 x 10-4 . (0,005)
r = 3 x 10-4 . 5 x 10-3
r = 15 x 10-7 M/s
Soal No. 9
Laju reaksi terhadap: 2HgCl2(aq) + C2O42-(aq) → 2CO2(g) + Hg2Cl2(s) + 2Cl–(aq). Diketahui dengan mengukur jumlah mol Hg2Cl2 yang mengendap tiap liter per menit, dan diperoleh data sebagai berikut.
| Percobaan ke – | [HgCl2]awal (M) | [C2O42-]awal (M) | Laju pembentukan Hg2Cl2 (M/menit) |
| 1 | 0,105 | 0,15 | 1,8 x 10-5 |
| 2 | 0,105 | 0,30 | 7,1 x 10-5 |
| 3 | 0,052 | 0,30 | 3,5 x 10-5 |
- Dari data tersebut, tentukan orde reaksi terhadap HgCl2 dan C2O42-, serta orde reaksi keseluruhan.
- Hitung nilai tetapan laju reaksinya (k)
- Hitung laju reaksi jika konsentrasi awal HgCl2 0,02 mol/L dan C2O42- 0,22 mol/L
Pembahasan:
1. orde reaksi terhadap HgCl2 dan C2O42-, serta orde reaksi keseluruhan.
Orde reaksi keseluruhan = x + y = 1 + 2 = 3
2. nilai tetapan laju reaksinya (k)
r = k [HgCl2]x [C2O42-]y
1,8 x 10-5 = k (0,105)1 (0,15)2
k = 1,8 x 10-5 / 2,36335 x 10-3
k = 7,62 x 10-3 M-2.detik-1
3. laju reaksi jika konsentrasi awal HgCl2 0,02 mol/L dan C2O42- 0,22 mol/L
r = k [HgCl2]x [C2O42-]y
r = 7,62 x 10-3 . (0,02)1 (0,22)2
r = 7,62 x 10-3 . 968 x 10-6
r = 7.376,16 x 10-9 M/s
Soal No. 10
Laju suatu reaksi menjadi dua kali lebih cepat pada setiap kenaikan suhu 100C. Jika pada suhu 200C reaksi berlangsung dengan laju 2 x 10-3 mol/L detik, berapa laju reaksi yang terjadi pada suhu 500C?
Pembahasan:
r50 = r20 (2)((50 – 20)/10)
r50 = 2 x 10-3 M/detik (2)3
r50 = 1,6 x 10-2 M/detik