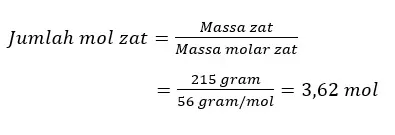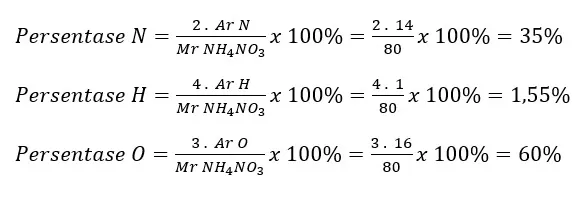Istilah stoikiometri berasal dari kata-kata Yunani yaitu Stoicheion (partikel) dan metron (pengukuran). Stoikiometri akhirnya mengacu pada cara perhitungan dan pengukuran zat serta campuran kimia. Berikut ini adalah contoh soal stoikiometri yang telah dilengakapi dengan pembahasannya.
Soal No. 1
Berapakah partikel atom yang terdapat dalam 2,5 mol atom 11Na23?
Pembahasan:
Jumlah partikel atom = 2,5 mol 11Na23 x Bilangan Avogadro
= 2,5 x 6,0225 x 1023
= 15,05625 x 1023 partikel atom 11Na23
Soal No. 2
Berdasarkan analisis spectrometer massa, kelimpahan relatif berbagai isotop silicon di alam adalah sebagai berikut: 92,23% 28Si, ,67% 29Si, dan 3,10% 30Si. Hitunglah massa atom relatif Silikon berdasarkan data tersebut!
Pembahasan:
Nila massa atom relatif merupakan nilai rata-rata ketiga isotop.
Ar Si = (0,9223 x 28) + (0,0467 x 29) + (0,0310 x 30)
= 25,8244 + 1,3543 + 0,93
= 28,1087
Soal No. 3
Berapakah massa molekul relatif CuSO4?
Pembahasan:
Massa molekul relatif merupakan jumlah massa atom relatif atom-atom penyusun senyawa, jadi.
Mr CuSO4 = (n . Ar Cu) + (n . Ar S) + (n . Ar O)
= (1 . 63,546) + (1 . 32,06) + (4 . 15,9994)
= 159,6036
Soal No. 4
Berapa mol-kah sebungkah besi murni yang ketika diuji massanya mempunyai massa 215 gram?
Pembahasan:
Bila diketahui massa molar (Fe) = 56 gram Fe/mol Fe. Artinya setiap 56 gram Fe merupakan 1 mol Fe.
Soal No. 5
Suatu contoh CdCl2 sebanyak 1,5276 gram direaksikan sehingga terbentuk suatu logam Kadmium dan senyawwa bebas Kadmium. Apabila massa logam Kadmium 0,367 gram dan massa molar Klor dianggap 35,453 gram Cl/mol Cl, berapakah massa molar Cd dalam reaksi ini?
Pembahasan:
Senyawa CdCl2 mempunyai massa: 1,5276 gram
Massa Cd dalam CdCl2 : 0,9367 gram
Jadi massa Cl dalam CdCl2: 0,5909 gram
Dari rumus molekul CdCl2 ternyata bahwa jumlah mol Cd dan Cl berbanding 1 : 2 sehingga:
Jumlah mol Cd = ½ mol Cl = ½ . 0,01667 mol = 0,008335 mol
Massa atom relatif Kadmium = massa molar Kadmium, yaitu:
Jadi massa atom relatif 1 mol Kadmium = 112,41 gram/mol
Soal No. 6
Bagaimana kita dapat membuat larutan AgNO3(aq) sebanyak 60 cm3 dengan larutan AgNO3 tersebut harus mengandung 0,03 gram AgNO3 tiap cm3?
Pembahasan:
Karena untuk 1 cm3 harus mengandung 0,03 g AgNO3, untuk 60 cm3 diperlukan: 60 x 0,03 g AgNO3 = 1,8 g AgNO3.
Jadi larutan 1,8 g AgNO3 dalam wadah labu ukur, aduk hingga semua zat AgNO3 terlarut dalam 50 cm3 aquades. Setelah homogen tambahkan aquades lagi hingga larutan mencapai volume 60 cm3.
Soal No. 7
Berapa larutan NaCl 5% yang harus diambil untuk memperoleh 3,2 gram NaCl?
Pembahasan:
5% NaCl artinya dalam 100 gram larutan terdapat 5 gram NaCl. Jadi 3,2 gram terkandung dalam 3,2 x (100/5 gram larutan) = 64 gram larutan
Jadi dapat diambil larutan NaCl 5% sebanyak 64 gram.
Soal No. 8
Hitunglah massa HCl anhidrat dalam 5,00 cm3 HCl pekat (kerapatan 1,19 g/cm3) yang mengandung 37,23% HCl.
Pembahasan:
Massa 5 cm3 larutan = volume x kerapatan = 5 cm3 x 1,19 = 5,95 gram
Larutan HCl bermassa 5,95 gram mengandung 37,23% HCl anhidrat.
Jadi, massa anhidrat dalam 5,95 gram larutan = 0,3723 x 5,95 gram = 2,22 gram HCl anhidrat.
Soal No. 9
Berapakah NaOH yang harus ditimbang untuk membuat larutan NaOH dengan konsentrasi 2M?
Pembahasan:
NaOH 2 M berarti dalam setiap 1 liter larutan NaOH terdapat 2 mol NaOH terlarut.
Jadi, massa zat terlarut = jumlah mol x massa molar NaOH
= 2 x (Ar Na + Ar O + Ar H)
= 2 (23 + 16 + 1)
= 2 x 40 = 80 gram
Soal No. 10
Berapakah KOH yang harus ditimbang untuk membuat KOH 1 N?
Pembahasan:
KOH 1 N mempunyai reaksi netralisasi:
KOH → K+ + OH–
Berarti 1 mol KOH dapat menghasilkan 1 mol OH, berarti perbandingan gram ekivalen dengan massa molekul = 1 : 1
Massa molekul KOH = Ar K + Ar O + Ar H = 39 + 16 + 1 = 56 gram ekivalen setara dengan 1/1 x 56 = 56 gram.
Soal No. 11
Molalitas suatu larutan etil alkohol (C2H5OH) dalam air = 1,54 mol/kg. Berapa gram alkohol yang terlarut dalam 2,5 kg air?
Pembahasan:
Massa molekul C2H5OH = 46
Karena m = 1,54 berarti 1 kg air melarutkan 1,54 mol alkohol
Jadi, dalam 2,5 kg air terdapat:
= 2,5 x 1,54 mol = 3,85 mol
Sehingga massa alkohol dalam 2,5 kg air yaitu:
= 3,85 mol x 46 g/mol = 177 gram
Soal No. 12
Tentukan fraksi mol kedua substansi dalam larutan yang mengandung 36,0 gram air dan 46 gram gliserin (C3H5(OH)3)
Pembahasan:
Mr Air = 18
Mr Gliserin = 92
Jumlah mol air = gr/Mr = 36/18 = 2 mol
Jumlah mol gliserin = gr/Mr = 46/92 = 0,5 mol
Soal No. 13
Untuk memperoleh larutan AgNO3 berkonsentrasi 16 mg/cm3 dari larutan AgNO3 berkonsentrasi 40 mg/cm3, berapa pengenceran yang harus dilakukan?
Pembahasan:
Misalkan V2 adalah volume larutan setelah pengenceran, dengan V1 bernilai 1 cm3 dan K1 = 40 mg/cm3
V1 x K1 = V2 x K2
1 cm3 x 40 mg/cm3 = V2 x 16 mg/cm3
V2 = 40/16 = 2,5 cm3
Jadi harus dilakukan pengenceran dari 1 cm3 larutan AgNO3 40 mg/cm3 menjadi bervolume 2,5 cm3
Besar pengenceran = V2/V1 = 2,5 cm3/1 cm3 = 2,5 kali
Banyaknya akuades yang harus ditambahkan untuk setiap 1 cm3
= 2,5 cm3 – 1 cm3 = 1,5 cm3
Soal No. 14
Suatu senyawa mempunyai komposisi 21,6% Na, 33,3% klor 45,1% oksigen. Bagaimana rumus molekulnya?
Pembahasan:
Andaikan senyawa tersebut mempunyai massa 100 gram, maka massa unsur-unsur penyusunnya:
Na = 100 gram x 21,6% = 21,6 gram
Cl = 100 gram x 33,3% = 33,3 gram
O = 100 gram x 45,1% = 45,1 gram
Komposisi unsur-unsur dalam senyawa merupakan perbandingan mol, maka:
Jumlah mol Na = gr/Ar = 21,6/23 = 0,93 mol
Jumlah mol Cl = gr/Ar = 33,3/35,5 = 0,93 mol
Jumlah mol O = gr/Ar = 45,1/16 = 2,8 mol
Jumlah mol Na : Jumlah mol Cl : Jumlah mol O = 0,93 : 0,93 : 2,8 = 1 : 1 : 3
Jadi perbandingan komposisi Na : Cl : O = 1 : 1 : 3
Rumus molekul = NaClO3
Soal No. 15
Hitunglah persentasi CaO dalam CaCO3.
Pembahasan:
Dengan adanya kesetaraan jumlah atom Ca dalam CaO dan CaCO3, dapat diturunkan suatu persamaan faktor kuantitatifnya.
Fraksi CaO dalam CaCO3 = (rumus molekul CaO/rumus molekul CaCO3) x 100%
= (56/100) x 100% = 56%
Soal No. 16
Berapa kilogram CaO yang dapat diperoleh dari 1000 kg batu gamping dengan kadar CaCO3 97%?
Pembahasan:
Banyaknya CaCO3 yang terdapat dalam 1000 kg batu gamping = 1000 kg x 97% = 970 kg
Banyaknya CaO yang terdapat dalam 970 kg CaCO3
= Fraksi CaO dalam CaCO3 x jumlah CaCO3 yang ada
= 56% x 970 kg
= 543,2 kg
Soal No. 17
Bagamana rumus empiris suatu hidrokarbon yang ketika dianalisis menghasilkan persentase C = 85,63% dan H = 14,37%
Pembahasan:
Andaikan senyawa tersebut bermassa 100 gram, maka:
Jumlah massa C = 85,63% x 100 gram = 85,63 gram
Jumlah massa H = 14,37% x 100 gram = 14,37 gram
Perbandingan mol C dan H = (85,63/12) : (14,37/1) = 7,129 : 14,37 = 1 : 2
Jadi rumus empiris yaitu CH2
Soal No. 18
Bagaimana persentase tiap unsur penyusun senyawa (NH4)NO3?
Pembahasan:
Persentase merupakan perbandingan massa unsur-unsur penyusun yang ada dengan massa rumus (massa molekul) senyawa.
Soal No. 19
Berapakah besi oksida (Fe2O3) yang diperoleh dari pembakaran 200 gram besi dengan oksigen sebanyak 50 liter? (Reaksi dalam kondisi standar).
Pembahasan:
Reaksi yang terjadi:
4 Fe + 3 O2 → 2Fe2O3
Artinya 4 mol Fe setara dengan 3 mol O2 menghasilkan 2 mol Fe2O3. Kini kita periksa jumlah pereaksi yang tersedia
Jumlah mol Fe = gr/Ar = 200/56 = 3,57 mol
Jumlah mol oksigen = V/22,4 = 50/22,4 = 2,2 mol
Periksa pereaksi mana ang akan menjadi pembatas reaksi.
Jika besi (3,57 mo) habis bereaksi, dibutuhkan O2 sebanyak:
= ¾ x 3,57 mol = 2,65 mol
Karena O2 yang ada hanya 2,2 mol, maka reaksi yang menyebabkan besi habis bereaksi tidak dapat berlangsung.
Jika O2 (2,2 mol) habis bereaksi, dibutuhkan besi sebanyak:
= 4/3 x 2,2 mol = 2,81 mol
Karena besi yang ada mencukupi kebutuhan untuk menghabiskan O2, maka reaksi tersebut lebih mungking berlangsung. Jadi O2 sebagai zat pembatas reaksi, sehingga Fe2O3 terbentuk
= 2/3 x 2,2 mol = 1,47 mol
Soal No. 20
Dari reaksi 1 mol CH4 dengan Cl2 berlebih diperoleh 83,5 gram CCl4. Berapakah hasil teoritis, hasil nyata dan persen hasil reaksi tersebut?
Pembahasan:
Reaksi:
CH4 + 4 Cl2 → CCl4 + 4 HCl
Hasil teoritis:
Jika dilihat dari persamaan reaksi, dari 1 mol CH4 diharapkan dapat diperoleh 1 mol CCl4. Sedangkan massa molar CCl4 = 154 gram.
Hasil nyata:
Dari reaksi yang terjadi hasil nyata = 83,5 gram
Persen hasil = (Hasil nyata/hasil teoritis) x 100% = (83,5/154) x 100% = 54,2%
Soal No. 21
Sebanyak 0,710 gram contoh logam campuran Magnesium yang mengandung 70% Al dan 30% Mg bereaksi dengan HCl(aq) berlebih. Berapakah massa H2 yang terbentuk?
Pembahasan:
Reaksi:
2Al(s) + 6 HCl(aq) → 2AlCl3(aq) + 3H2(g)
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Tentukan massa tiap logam berdasarkan persen komposisinya.
Al = 70% x 0,710 gram = 0,447 gram
Mg = 30% x 0,710 gram = 0,213 gram
Tentukan jumlah mol masing-masing logam
Jumlah mol Al = gr/Ar = 0,447/27 = 0,0184 mol
Jumlah mol Mg = gr/Ar = 0,213/24 = 0,00877 mol
Berdasarkan reaksi, dapat ditentukan jumlah mol H2 yang dihasilkan:
Oleh Al = 3/2 x 0,0184 mol = 0,0276 mol
Oleh Mg = 1/1 x 0,00877 mol = 0,00877 mol
Jumlah keseluruhan = 0,0276 + 0,00877 = 0,0364 mol
Jika H2 dinyatakan dalam gram maka:
gram H2 = (2 gram H2/1 mol H2) x 0,0364 mol= 0,0735 gram
Soal No. 22
Reaksi berurutan
KClO4 dapat dibuat melalui seri reaksi berikut ini.
Cl2 + 2KOH → KCl + KClO + H2O ……………. (1)
3KClO → 2 KCl + KClO3 ………………………….. (2)
4KClO3 → 3 KClO4 + KCl ………………………….(3)
Berapakah gas Cl2 yang dibutuhkan untuk mendapatkan 100 gram KClO4 berdasarkan reaksi diatas?
Pembahasan:
Jika n melambangkan jumlah mol
dari …… (1) = n (KClO) = n (Cl2)
dari …….(2) = n(KClO3) = 1/3 n (KClO) = 1/3 n (Cl2)
dari …….(3) = n(KClO4) = 3/4 n(KClO3)
= (3/4) (1/3) n Cl2
= 1/4 . n . Cl2
Dengan n (KClO4) = gr KClO4/Mr KClO4 = 100/139 = 0,72 mol
n Cl2 = 4 x 0,72 mol = 2,88 mol
massa Cl2 = n x Mr Cl2
massa Cl2 = 2,88 x 71 = 204 gram
Soal No. 23
Suatu sampel senyawa mengandung 27 gram unsur aluminium dan 24 gram unsur oksigen. Tentukan rumus empirisnya jika diketahui: Ar Al = 27 dan O = 16.
Pembahasan:
Jumlah mol Al = gram/Ar = 27/27 = 1 mol
Jumlah mol O = gram/Ar = 24/16 = 1,5 mol
Dengan menggunakan perbandingan jumlah mol Al : jumlah mol O maka
jumlah mol Al : jumlah mol O = 1 : 1,5 = 2 : 3
Jadi, rumus empiris sampel senyawa tersebut adalah Al2O3.
Soal No. 24
Suatu senyawa hidrokarbon memiliki komposisi zat 80% unsur karbon dan 20% unsur hidrogen. Tentukan rumus empirisnya jika Ar C = 12 dan Ar H = 1.
Pembahasan:
Rumus empiris ditentukan dari persentase komposisi senyawa yang dianggap memiliki massa 100 gram.
Jumlah mol C = gr/Ar = 80/12 = 6,6 mol
Jumlah mol H = gr/Ar = 20/1 = 20 mol
Perbandingan jumlah mol C : jumlah mol H = 6,6 : 20 = 1 : 3
Rumus empiris senyawa hidrokarbon tersebut adalah CH3.
Soal No. 25
Menentukan rumus empiris berdasarkan persen massa unsur-unsur penyusun zat vanila yang digunakan untuk memberi cita rasa makanan mempunyai komposisi 63,2% C; 5,2% H; dan 31,6% O. (Ar C = 12, H = 1, dan O = 16). Tentukan rumus empirisnya!
Pembahasan:
Untuk menentukan rumus empiris vanilin, kita harus menghitung perbandingan jumlah mol C, H, dan O. Misalkan dalam 100 gram sampel vanila.
Jumlah mol C = gr/Ar = 63,2/12 = 5,27 mol
Jumlah mol H = gr/Ar = 5,2/1 = 5,2 mol
Jumlah mol O = gr/Ar = 31,6/16 = 1,98 mol
Diperoleh perbandingan:
jumlah mol C : jumlah mol H : jumlah mol O = 5,27 : 5,2 : 1,98 = 8 : 8 : 3
Jadi, rumus empiris vanila adalah C8H8O3.