Soal No. 16
Tentukan gaya-gaya antarmolekul yang terdapat pada senyawa HBr dan CHCl3.
Pembahasannya:
- Gaya antarmolekul yang terdapat pada senyawa HBr adalah gaya dipol-dipol.
- Gaya antarmolekul yang terdapat pada senyawa CHCl3 adalah gaya London (gaya dispersi).
Soal No. 17
Perhatikan rumus struktur kimia berikut.
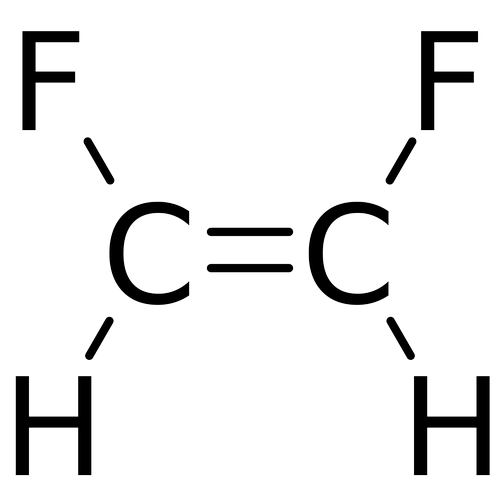
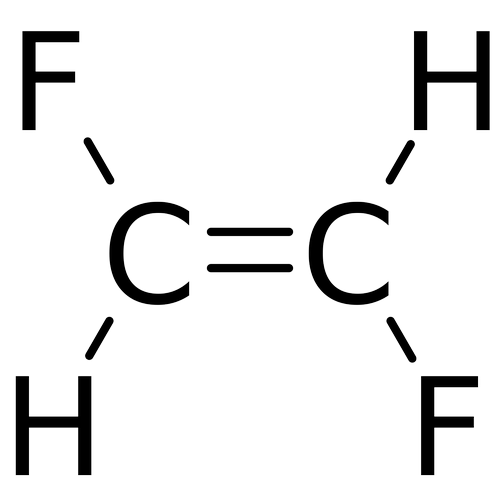
Manakah yang mempunyai titik didih rendah? Jelaskan.
Pembahasannya:
Yang mempunyai titik didih rendah adalah Trans-1,2-difluoroethylena. Trans-1,2-diflouroethylena mempunyai titik didih lebih rendah karena kurang polar dan lebih simetri.
Soal No. 18
Jelaskan mengapa titik didih benzena (C6H6) lebih tinggi dibandingkan titik didih metana (CH4)? (Titik didih benzene = 80,20C; titik didih metana = -161,50C).
Pembahasannya:
Titik didih benzena (C6H6) lebih tinggi dibandingkan titik didih metana (CH4) karena mempunyai rantai karbon yang lebih panjang. Semakin panjang rantai karbon suatu senyawa hidrokarbon, semakin membutuhkan energi yang lebih besar untuk memutus ikatan rantai karbon tersebut.
Soal No. 19
Sebutkan jenis gaya antarmolekul yang terdapat pada pasangan molekul berikut!
- HBr dan H2S
- Cl2 dan CBr4
- NH3 dan C6H6
Pembahasannya:
1. HBr merupakan senyawa polar dan H2S juga merupakan senyawa polar. Karena ikatannya berasal dari molekul polar-polar maka jenis gaya antarmolekul yang terjadi adalah gaya dipol-dipol.
2. Cl2 merupakan senyawa nonpolar dan CBr4 merupakan senyawa nonpolar. Sehingga gaya antarmolekul yang terjadi adalah gaya London.
3. NH3 dan C6H6
Soal No. 20
Manakah diantara molekul-molekul berikut yang mampu berikatan hidrogen antar molekul itu sendiri?
- C2H6
- HI
- BeH2
- CH3COOH
Pembahasannya:
yang mampu berikatan hidrogen antar molekul itu sendiri adalah molekul CH3COOH. Hal ini disebabkan karena ikatan hidrogen hanya terjadi antara unsur H dengan unsur N, O, dan F.