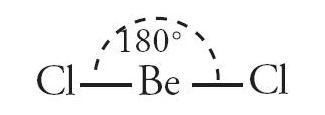Soal No. 1
Ramalkan bentuk molekul BeCl2 dengan teori hibridisasi. (Ar Be: 4; Cl: 17)
Penyelesaiannya:
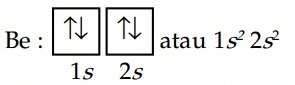
Kita tuliskan dulu konfigurasi elektron kedaan dasar atom Be.
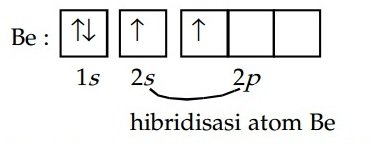
Karena akan berikatan dengan atom Cl, maka elektron terluar atom Be mengalami hibridisasi sehingga membentuk konfigurasi elektron terhibridisasi.
Dua elektron tidak berpasangan pada orbital 2s dan 2p akan menerima elektron dari Cl untuk membentuk ikatan kovalen sehingga terbentuk senyawa BeCl2 dengan bentuk geometri linear dengan hibridisasi sp.
Soal No. 2
Ramalkan bentuk molekul BF3 berdasarkan teori hibridisasi! (Ar B: 5; F: 9)
Penyelesaiannya:
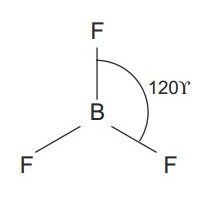
Tiga elektron yang tidak berpasangan pada konfigurasi elektron B terhibridisasi akan berpasangan dengan elektron atom F membentuk ikatan kovalen BF3 dengan bentuk molekul segitiga planar.
Soal No. 3
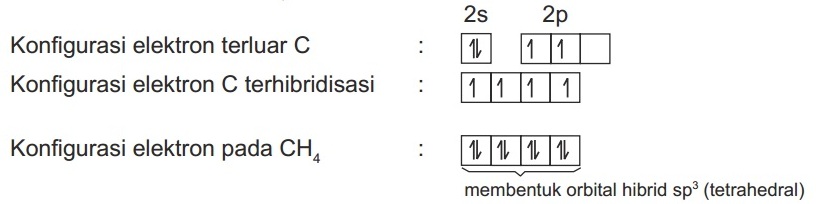
CH4 mempunyai struktur tetrahedral, dengan empat buah domain elektron ikatan pada empat arah yang sama. Maka bentuk hibridisasi yang terjadi pada CH4 adalah ….
A. sp
B. sp3
C. sp3d2
D. sp2
E. sp3d
Jawaban: B
Penyelesaiannya:
Konfigurasi elektron atom 6C = 1s2 2s2 sp2
Empat elektron yang tidak berpasangan pada konfigurasi elektron C terhibridisasi akan berpasangan dengan elektron dari atom H sehingga membentuk orbital hibrid sp3 (tetrahedral).
Soal No. 4
Jika nomor atom B = 5 dan nomor atom Cl = 17. Orbital hibrida yang terjadi pada molekul BCl3 adalah ….
A. sp
B. sp2
C. sp3
D. sp3d
E. sp3d2
Jawaban: B
Penyelesaiannya:
Cara penyelesaiannya sama persis seperti soal no.2.
Soal No. 5
Bentuk molekul bipiramida trigonal memiliki orbital hibrida ….
A. sp
B. sp2
C. sp3
D. sp3d
E. sp3d2
Jawaban: D
Penyelesaiannya:
Bentuk molekul berdasarkan teori hibridisasi dapat kita lihat dalam tabel bentuk molekul berikut.
| Jenis Orbital | Orbital Hibrida | Bentuk Molekul | Contoh |
| s dan p | sp | Linear | BeCl2 |
| s dan p | sp2 | Segitiga planar | BF3 |
| s dan p | sp3 | Tetrahedral | CH4 |
| s, p, dan d | sp3d | Bipiramida trigonal | PCl5 |
| s, p, dan d | sp3d2 | Oktahedral | SF6 |