Denaturasi protein merupakan hilangnya fungsi biologis suatu protein karena adanya perubahan struktur protein. Kembalinya fungsi biologis protein dari keadaan terdenaturasi dinamakan dengan renaturasi.
Denaturasi protein dapat terjadi karena adanya beberapa faktor yang mempengaruhi seperti pengaruh pemanasan, tekanan, pengadukan, pH, pelarut organik, senyawa organik, detergen, dan penambahan garam.
1. Panas

Ketika larutan protein dipanaskan secara bertahap di atas suhu kritis, protein mengalami transisi dari keadaan asli ke terdenaturasi. Mekanisme suhu menginduksi denaturasi protein cukup kompleks dan menyebabkan destabilisasi interaksi non kovalen di dalam protein.
Ikatan hidrogen, interaksi elektrostatik, dan gaya van der Waals bersifat eksotermis, sehingga mengalami destabilisasi pada suhu tinggi dan mengalami stabilisasi pada suhu rendah.
Sebaliknya, interaksi hidrofobik bersifat endotermis, sehingga mengalami destabilisasi pada suhu rendah dan mengalami stabilisasi pada suhu tinggi. Ikatan hidrogen antar ikatan peptida kebanyakan terkubur di bagian dalam struktur protein, sehingga tetap stabil pada berbagai kisaran suhu.
Akan tetapi, stabiilitas interaksi hidrofobik tidak dapat meningkat secara tajam dengan meningkatnya suhu. Hal tersebut disebabkan setelah melewati suhu tertentu, struktur air secara bertahap pecah dan menyebabkan denaturasi interaksi hidrofobik.
2. Tekanan
Denaturasi akibat tekanan terjadi pada suhu 25°C jika tekanan yang diberikan cukup tinggi. Kebanyakan protein mengalami denaturasi pada tekanan 1-12 kbar. Tekanan dapat menyebabkan denaturasi protein karena protein bersifat fleksibel dan dapat dikompresi.
Walaupun residu asam amino tersusun rapat di bagian dalam protein globular, biasanya masih terdapat rongga di dalam protein. Akibatnya, protein bersifat dapat dikompresi dan terjadi penurunan volume protein.
Penurunan volume tersebut disebabkan rongga yang hilang dalam struktur protein dan hidrasi protein. Denaturasi akibat tekanan bersifat reversibel.
3. Pengadukan
Pengadukan mekanik kecepatan tinggi seperti pengocokan, pengulenan, dan pembuihan menyebabkan protein terdenaturasi. Banyak protein yang terdenaturasi dan mengalami presipitasi ketika diaduk intensif.
Denaturasi terjadi akibat inkorporasi udara dan adsorpsi molekul protein ke dalam antarmuka udara-cairan. Energi untuk antarmuka udara-cairan lebih besar dibandingkan fase curah sehingga protein mengalami perubahan konformasi dipengaruhi oleh fleksibilitas protein.
Protein dengan feksibilitas tinggi lebih cepat berada pada antarmuka udara-cairan, sehingga terdenaturasi lebih cepat dibandingkan protein yang kaku (rigid).
Ketika pengadukan tinggi dilakukan menggunakan pengaduk berputar maka akan terbentuk kavitasi. Keadaan ini menyebabkan protein mudah terdenaturasi. Pengadukan yang lebih cepat menyebabkan tingkat denaturasi yang lebih tinggi.
4. pH
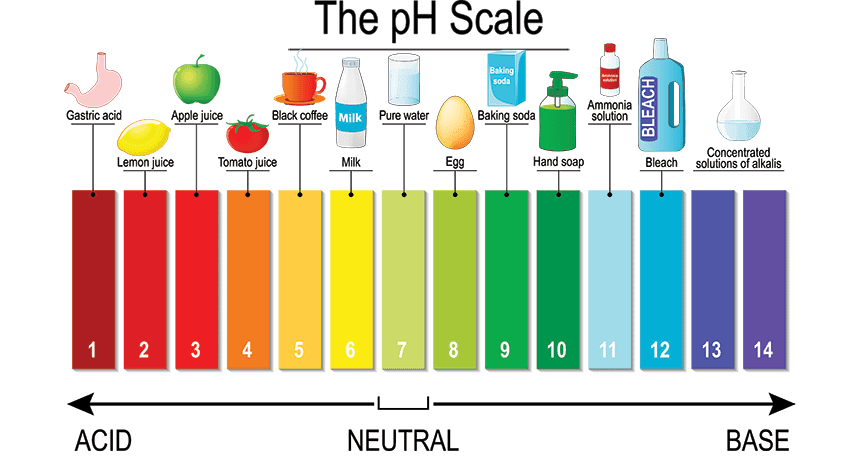
Protein bersifat lebih stabil pada pH di titik isoelektrik dibandingkan pH lain. Pada pH netral, kebanyakan protein bermuatan negatif dan hanya sedikit yang bermuatan positif.
Rendahnya gaya tolak elektrostatik dibandingkan interaksi yang lain, menjadikan kebanyakan protein bersifat stabil pada pH mendekati netral. Pada pH ekstrem, gaya tolak elektrostatik dalam molekul protein yang disebabkan muatan tinggi mengakibatkan struktur protein membengkak dan terbuka.
Derajat terbukanya struktur protein lebih besar pada pH alkali dibandingkan pada pH asam. Pada kondisi alkali terjadi ionisasi gugus karboksil, fenolik, dan sulfihidril di bagian dalam protein sehingga struktur protein terbuka dengan tujuan mengekspos gugus tersebut pada fase air.
Denaturasi protein akibat pH kebanyakan bersifat reversibel. Akan tetapi, pada sejumlah kasus hidrolisis ikatan peptida secara parsial, deamiadase residu asparagin dan glutamin, dan kerusakan gugus sulfihidril pada pH alkali dapat menyebabkan denaturasi protein yang bersifat irreversibel.
5. Pelarut Organik
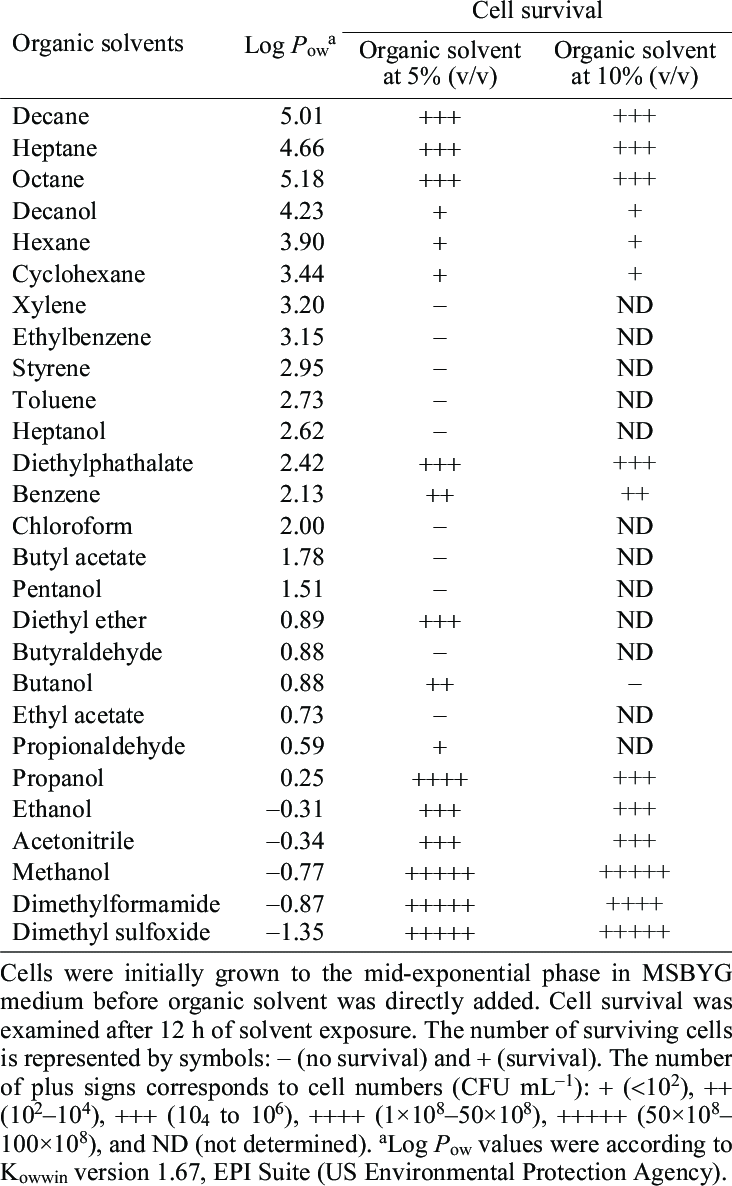
Pelarut organik mempengaruhi stabilitas interaksi hidrofobik protein, ikatan hidrogen, dan interaksi elektrostatik. Rantai samping residu asam amino nonpolar lebih larut pada pelarut organik dibandingkan air. Hal tersebut mengakibatkan interaksi hidrofobik menjadi lemah.
Sebaliknya, stabilitas dan pembentukan ikatan hidrogen antarikatan peptida meningkat pada lingkungan dengan permisivitas rendah maka sejumlah pelarut organik dapat meningkatkan atau memperkuat pembentukan ikatan hidrogen antar ikatan peptida.
Pada konsentrasi rendah, sejumlah pelarut organik dapat menstabilkan beberapa enzim terhadap denaturasi. Pada konsentrasi tinggi, pelarut organik menyebabkan protein terdenaturasi karena efek pelarutan rantai samping nonpolar.
6. Senyawa Organik
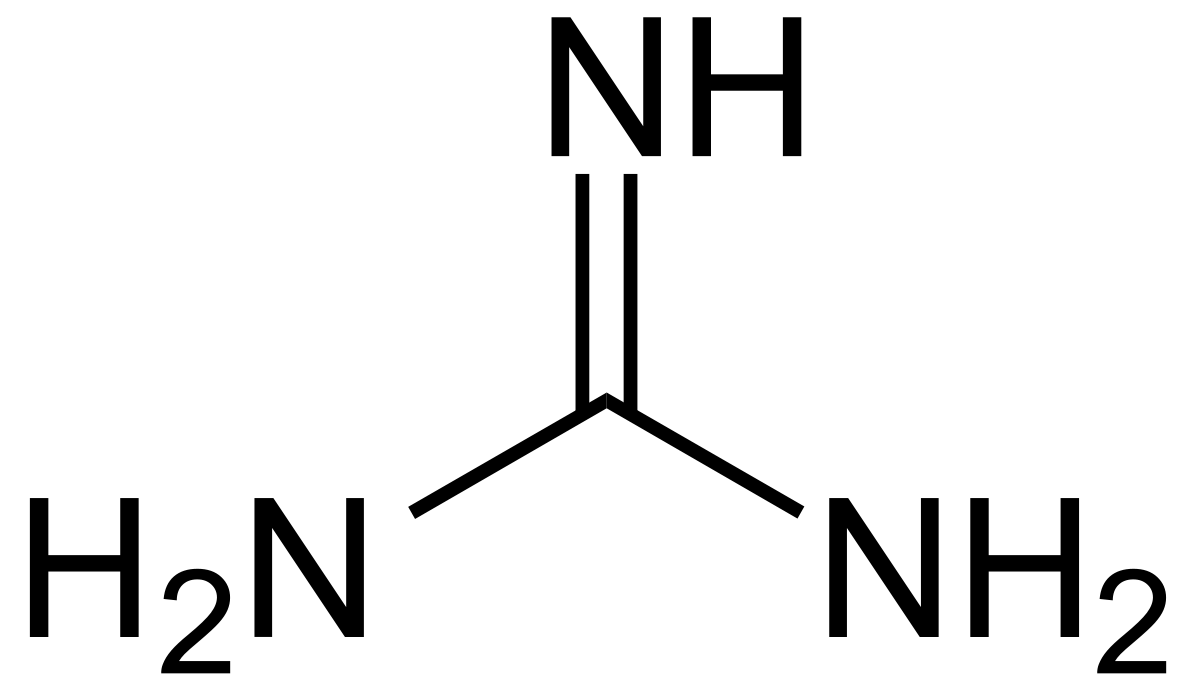
Sejumlah senyawa organik seperti urea dan guanidin hidroksida menyebabkan denaturasi protein. Urea dan guanidin pada konsentrasi tinggi membentuk ikatan hidrogen dan menyebabkan ikatan hidrogen dalam air menjadi terganggu.
Rusaknya ikatan hidrogen antarmolekul air menjadikan air sebagai pelarut yang baik untuk residu nonpolar. Dampaknya adalah struktur protein terbuka dan terjadi pelarutan residu nonpolar dari bagian dalam molekul protein.
7. Detergen

Detergen seperti Sodium Dodecyl Sulfate (SDS) merupakan pendenaturasi protein yang kuat. Detergen terikat kuat pada protein yang terdenaturasi sehingga menyempurnakan denaturasi. Akibatnya, denaturasi protein menjadi bersifat irreversibel.
8. Penambahan Garam

Garam mempengaruhi stabilitas struktural protein. Hal ini berkaitan dengan kemampuan garam untuk mengikat air secara kuat dan mengubah sifat hidrasi protein.
Pada konsentrasi rendah, garam menstabilkan struktur protein karena meningkatkan hidrasi protein dan terikat lemah pada protein. Sebaliknya, garam juga dapat menyebabkan ketidakstabilan struktur protein karena menurunkan hidrasi protein dan berikatan kuat dengan protein.
Pengaruh garam untuk stabilisasi atau destabilisasi struktur protein berkaitan dengan konsentrasi dan pengaruhnya terhadap ikatan air-air. Peningkatan stabilitas protein pada kadar garam rendah disebabkan peningkatan ikatan hidrogen antarmolekul air.
Sebaliknya, pada konsentrasi tinggi, garam mendenaturasi protein karena merusak struktur air sehingga air menjadi pelarut yang baik untuk residu nonpolar protein.