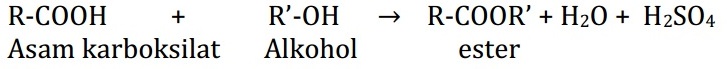Asam alkanoat dan alkil alkanoat merupakan senyawa turunan hidrokarbon yang mempunyai gugus atom yang menentukan struktur dan sifat dari senyawa karbon, yang disebut gugus fungsi.
1. Struktur Molekul Asam Alkanoat dan Alkil Alkanoat
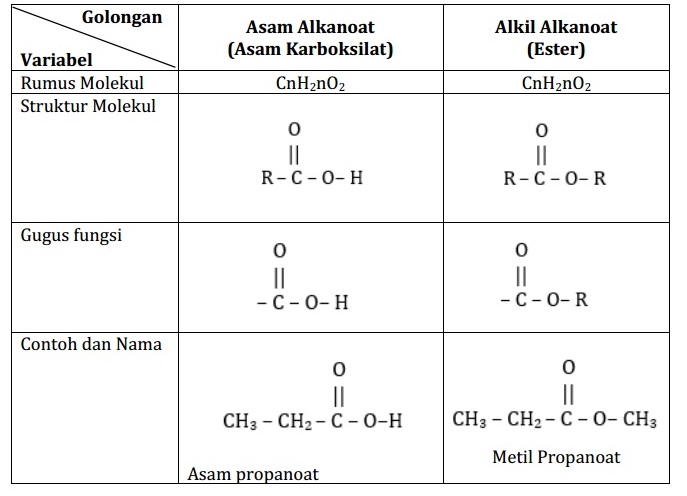
Perbandingan atau perbedaan struktur molekul asam alkanoat dan alkil alkanoat disajikan dalam tabel berikut.
2. Tata Nama Senyawa Asam Alkanoat (Asam Karboksilat)
Penamaan sistem IUPAC senyawa asam alkanoat mengikuti penamaan senyawa alkana di mana akhiran “a” diubah dengan “oat” dan ditambahkan kata “asam” di depannya. Penomoran dimulai dari atom C yang mengandung gugus fungsi asam alkanoat (COOH).
Contoh Tata Nama Senyawa Asam Alkanoat:
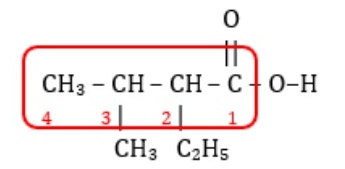
Pada senyawa di atas terdapat 4 atom karbon yang mengandung gugus asam alkanoat di sebelah kanan sehingga atom C yang paling kanan diberi nomor 1. Selain itu, juga terdapat cabang etil di atom C nomor 2 serta cabang metil di atom C nomor 3 sehingga senyawa diatas diberi nama Asam-2-etil-3-metilbutanoat.
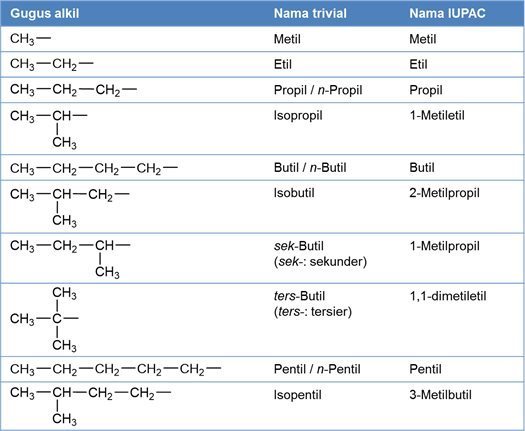
3. Tata Nama Senyawa Alkil Alkanoat (Ester)
Sistem IUPAC penamaan senyawa alkil alkanoat sama saja dengan senyawa asam alkanoat dengan menambah akhiran “oat” dan mengganti istilah asam pada asam alkanoat dengan gugus alkil yang bersesuain. Beberapa gugus alkil disajikan dalam tabel berikut.
Contoh tata nama senyawa alkil alkanoat:
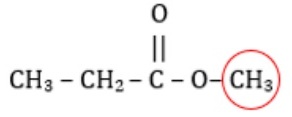
Pada senyawa di atas terdapat 3 atom karbon pada rantai utama dan terdapat cabang 1 atom karbon merupakan gugus alkil yang berupa metil. Sehingga nama senyawa tersebut adalah metil-propanoat.
4. Sifat Senyawa Asam Alkanoat (Asam Karboksilat)
Sifat fisik asam alkanoat yaitu:
- Pada temperatur kamar, asam alkanoat yang bersuku rendah adalah zat cair encer, suku tengah berupa zat cair yang kental dan suku tinggi berupa zat padat yang tidak larut dalam air.
- Titik didih dan titik leleh asam alkanoat relatif tinggi karena kuatnya tarik menarik antarmolekul. Bahkan, lebih tinggi dari alkohol yang bersesuaian.
- Asam alkanoat suku rendah dapat larut dalam air, tetapi asam alkanoat suku tinggi sukar larut dalam air.
- Asam alkanoat dapat terionisasi sebagian dalam air, sehingga termasuk senyawa elektrolit lemah.
Sifat kimia asam alkanoat yaitu:
- Mempunyai ikatan hidrogen sesamanya dan dapat berikatan secara ikatan hidrogen dengan molekul air.
- Asam alkanoat mempunyai gugus hidroksil yang bersifat polar sehingga asam alkanoat bersifat polar.
- Kereaktifan asam alkanoat merupakan asam lemah dan makin lemah untuk suku yang lebih tinggi.
- Bersifat asam.
5. Sifat Alkil Alkanoat (Ester)
Sifat fisik alkil alkanoat (ester) yaitu:
- Alkil alkanoat bersuku rendah berwujud cair encer, suku tengah berwujud cair kental, dan suku tinggi berwujud padat.
- Titik didih dan titik leleh rendah karena tidak memiliki ikatan Hidrogen.
- Alkil alkanoat bersuku rendah sedikit larut dalam air, sedangkan suku tinggi mudah larut dalam air.
- Termasuk ke dalam senyawa non elektrolit.
Sifat kimia alkil alkanoat (ester) yaitu:
- Tidak dapat membentuk ikatan Hidrogen, namun dapat membentuk ikatan van der waals.
- Senyawa bersuku rendah sedikit polar, sedangkan senyawa bersuku tinggi hampir non polar.
- Kurang reaktif.
- Bersifat nitral.
6. Reaksi-Reaksi Asam Alkanoat (Asam Karboksilat)
- Reaksi dengan basa (penyabunan): R-COOH + NaOH → R-COONa + H2O
- Reaksi dengan PCl5: R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
- Reaksi dengan NH3: R-COOH + NH3 → R-CONH2 + H2O
- Reaksi dengan Cl2: CH3 – CH2 – COOH + Cl2 → R – CHCl – COOH + HCl
7. Reaksi-Reaksi Alkil Alkanoat (Ester)
- Proses hidrolisis dalam suasana asam: R – COO – R‘ + H2O → R – CO – OH + R’ – OH
- Proses hidrolisis dalam suasana basa: R – COO – R’ + OH– → R – CO – O– + R’ – OH
8. Pembuatan Asam Alkanoat dan Alkil Alkanoat
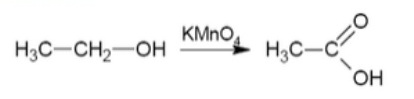
Asam alkanoat dapat dibuat melalui reaksi oksidasi alkohol primer dengan katalis kalium permangat. Contoh reaksinya:
Alkil alkanoat dapat dibuat melalui reaksi esterifikasi, yaitu dengan mereaksikan asam alkanoat (asam karboksilat) dengan alkol. Nantinya akan menghasilkan alkil alkanoat (ester), air, dan asam sulfat.
9. Kegunaan Asam Alkanoat
Asam alkanoat yang berupa asam asetat banyak digunakan:
- Dalam bidang industri sebagai bahan baku sintesis serat dan plastik
- Dalam labooratorium sebagai pelarut dan pereaksi
Asam alkanoat yang berupa asam oksalat banyak digunakan:
- Sebagai penghilang karat
- Sebagai bahan baku pembuatan zat warna
- Untuk mengasamkan minuman dan makanan
- Dalam fotografi, keramik, penyamakan, dan proses produksi lainnya
10. Kegunaan Alkil Alkanoat
- Alkil alkanoat (ester) seuku rendah atau tengah banyak ditemukan dalam buah-buahan sebagai aroma misalnya etil format dalam rum, n-pentil asetat dalam pisang, isopropil asetat dalam buah pir, n-oktil astat dalam jeruk manis, metal butirat dalam apel, dan etil butirat dalam nanas.
- Alkil alkanoat suku tengah atau tinggi banyak terdapat dalam lemak dan minyak.
- Alkil alkanoat suku tinggi banyak digunakan sebagai bahan baku pembuatan lilin.