Gaya antarmolekul adalah interaksi antara atom-atom dalam senyawa atau kumpulan molekul dalam senyawa yang mengalami tarik-menarik. Kuat lemahnya gaya tarik-menarik antarmolekul akan berpengaruh terhadap tinggi rendahnya titik didih suatu senyawa. Urutan kekuatan gaya antarmolekul berdasarkan kekuatan dari yang terlemah hingga yang terkuat adalah sebagai berikut.
1. Gaya Van der Waals
Gaya Van der Waals merupakan gaya antarmolekul yang sangat lemah. Gaya Van der Waals dikemukakan oleh Diderik Van der Waals pada awal abad ke- 20. Gaya Van der Waals dibagi menjadi dua, yaitu gaya London dan gaya tarik dipol.
2. Gaya London
Gaya London merupakan gaya tarik-menarik antarmolekul nonpolar akibat adanya dipol terimbas yang ditimbulkan oleh perpindahan elektron dari satu orbital ke orbital yang lain membentuk dipol sesaat. Kemudahan suatu molekul menghasilkan dipol sesaat yang dapat mengimbas ke molekul di sekitarnya disebut polarisabilitas. Semakin mudah molekul mengalami polarisasi, semakin tinggi titik didih dan titik lelehnya, sehingga gaya London semakin kuat. Sebaliknya, semakin sukar molekul mengalami polarisasi, semakin rendah titik didih dan titik lelehnya pula, sehingga gaya London semakin lemah. Oleh Karena itu, jika massa atom molekul relatif zat semakin besar, titik didih dan titik lelehnya semakin tinggi.
3. Gaya Tarik Dipol
Gaya Tarik Dipol terjadi karena kecenderungan molekul-molekul polar yang menyusun diri dengan cara saling mendekati kutub positif dari suatu molekul dengan kutub negatif molekul lain. Semakin besar momen dipol yang dimiliki suatu senyawa, semakin besar gaya tarik dipol yang dihasilkan. Gaya tarik dipol dibagi menjadi 3 jenis, yaitu:
a. Interaksi Dipol Terimbas (Dipol Terinduksi)
Gaya antarmolekul ini terjadi saat molekul polar mengimbas molekul nonpolar. Sebagai contoh, molekul air (H2O) yang bersifat polar dapat menginduksi molekul oksigen (O2) yang bersifat nonpolar. Dipol terimbas inilah yang mengakibatkan gas oksigen larut dalam air.
b. Interaksi Ion-Dipol
Gaya antarmolekul ini terjadi saat kation maupun anion berinteraksi dengan molekul polar. Kekuatan interaksi ini bergantung pada muatan dan ukuran ion serta kepolaran dan ukuran molekul polar.
c. Interaksi Dipol-Dipol
Gaya antarmolekul ini terjadi jika ujung positif dari salah satu molekul dipol ditarik ke ujung negatif dari dipol molekul lainnya.
4. Ikatan Hidrogen
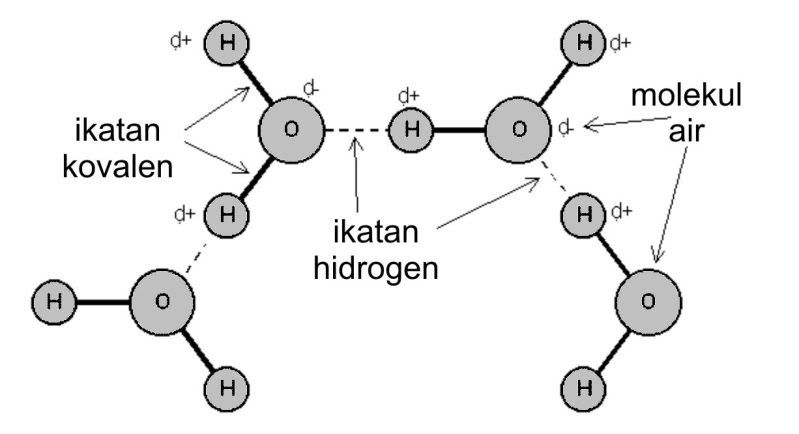
Ikatan Hidrogen merupakan gaya antarmolekul yang terjadi karena gaya tarik-menarik antara atom hidrogen dari molekul yang satu dengan atom molekul lain yang sangat elektronegatif seperti (F, O, dan N). Ikatan hidrogen jauh lebih kuat daripada gaya-gaya Van der Waals.
Sebagai contoh, dalam molekul air, atom O bersifat sangat elektronegatif sehingga pasangan elektron antara atom O dan H lebih tertarik ke arah atom O. Dalam keadaan cair, atom hidrogen ditarik oleh pasangan elektron atom O molekul lain yang elektronegatif, sehingga terbentuk ikatan hidrogen. Akibatnya, atom H dari salah satu molekul terikat kuat pada atom unsur yang sangat elektronegatif dari molekul yang lainnya melalui pasangan elektron bebas pada atom yang memempunyai elektronegatifan besar tersebut.