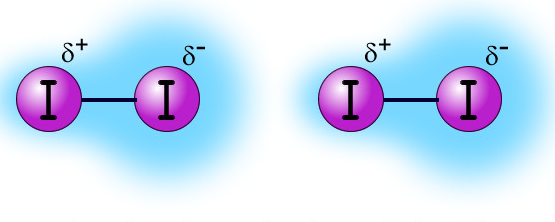Interaksi antar partikel adalah gaya tarik antar partikel yang berdekatan. Ada tiga jenis interasi antar partikel, yaitu ikatan hidrogen, gaya van der waals, dan gaya london. Ketiga jenis interaksi antar partikel tersebut memiliki ikatan yang lebih lemah daripada ikatan ion dan ikatan kovalen yang mengikat atom dan ion menjadi satu dalam unsur dan senyawa.
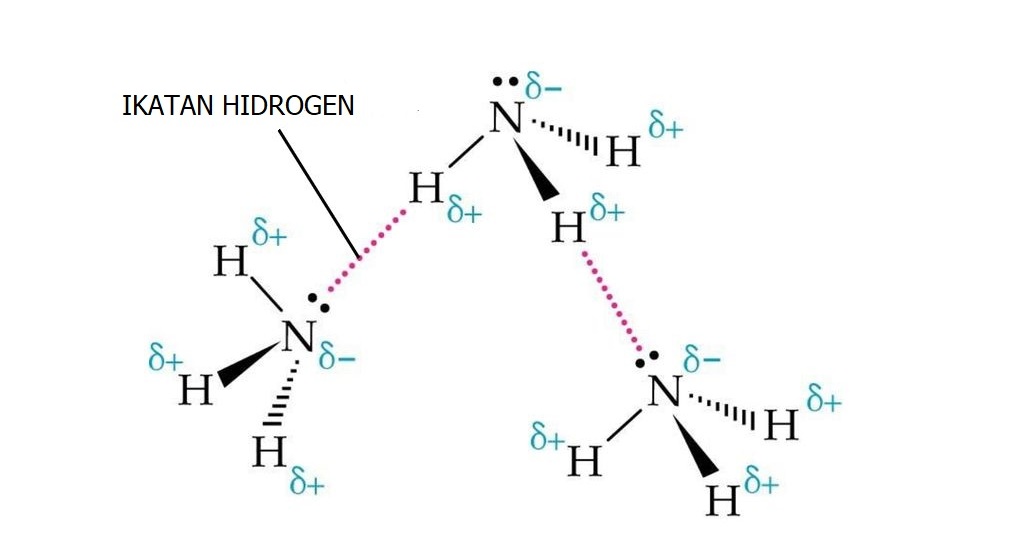
1. Ikatan Hidrogen
Ikatan Hidrogen terjadi ketika atom H dari 1 molekul tertarik ke atom yang sangat elektronegatif. Atom-atom yang sangat elektronegatif yaitu Nitorgen (N), Oksigen (O), dan Fluor (F). Ikatan hidrogen terjadi pada setiap senyawa yang mempunyai ikatan N-H, O-H, dan F-H contohnya pada molekul NH3, H2O, dan HF.
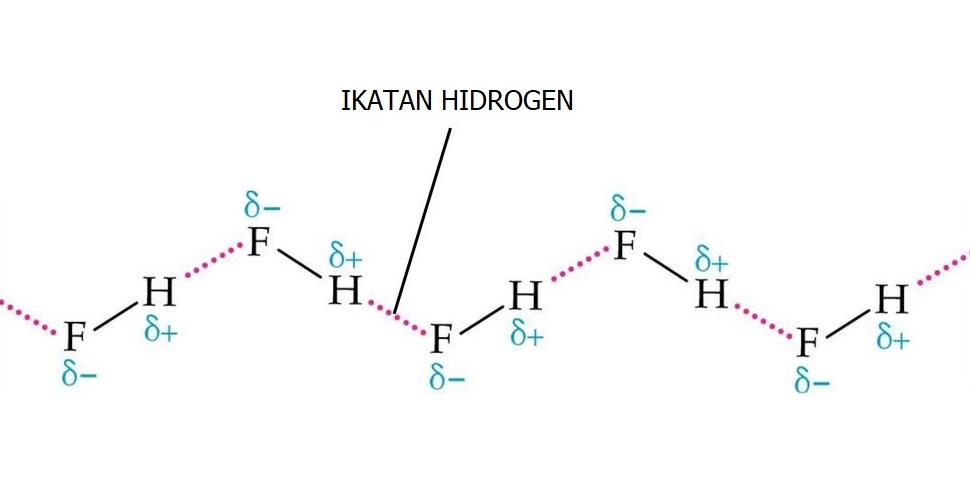
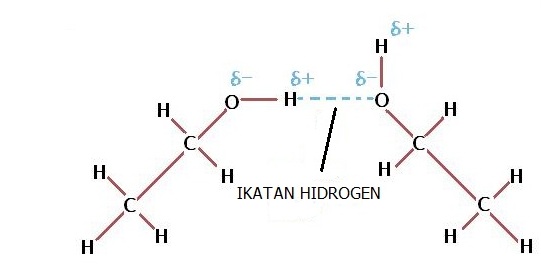
2. Gaya van der Waals
Gaya van der Waals adalah gaya tarik antar molekul dalam suatu molekul kovalen yang dapat disebabkan oleh tiga hal, yaitu dipol-dipol, ion-dipol, dan dipol sesaat (Gaya London).
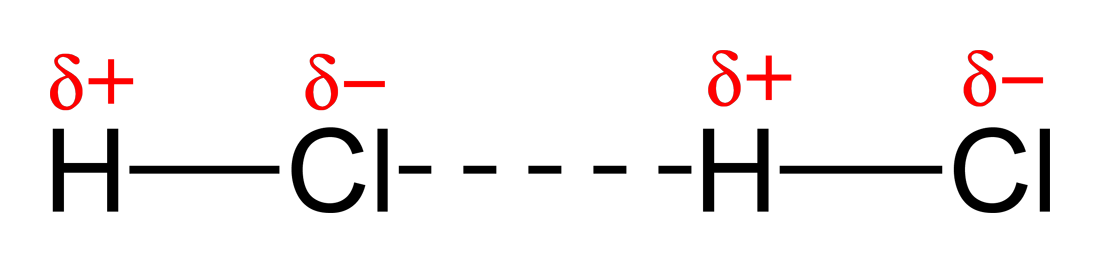
- Dipol-Dipol adalah gaya tarik menarik antara molekul polar dengan molekul polar. Contohnya, interaksi antar molekul HCl.
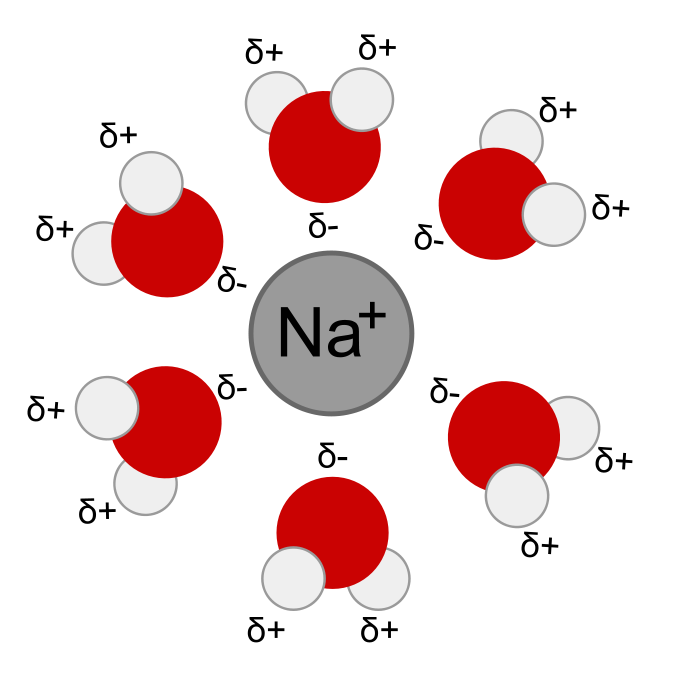
- Ion-dipol adalah gaya tarik menarik antara ion dengan molekul polar. Contohnya, interaksi antara molekul air dengan ion Al3+ dalam larutan AlCl3. Setiap ion Al3+ akan dikelilingi oleh 6 molekul air.
- Dipol Sesaat (Gaya London) adalah gaya tarik menarik antara molekul non polar dengan molekul non polar yang disebabkan oleh persebaran elektron yang tidak merata.