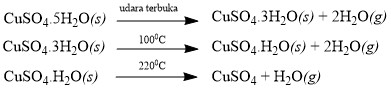
Senyawa hidrat adalah kristal yang mengikat molekul air sebagai bagian dari struktur kristralnya dengan jumlah tertentu. Jika senyawa hidrat melepaskan air kristal yang terikat disebut senyawa anhidrat. Perhitungan kadar air yang terdapat di dalam senyawa hidrat dapat dilakukan dengan berbagai cara, misalnya dengan memanaskan kristal sehingga air kristalnya terlepas. Kemudian, dari massa kristal sebelum dan sesudah pemanasan dapat ditentukan massa air kristalnya. Perhatikan reaksi berikut!
Jika senyawa hidrat ternyata tidak stabil pada proses pemanasan, maka penentuan jumlah air kristal dapat dilakukan dengan menganalisis melalui reaksi kimia.
Perhatikan contoh soal senyawa hidrat berikut ini untuk lebih memahami materi senyawa hidrat!
Contoh Soal No. 1
Kristal Zn(NO3)2.xH2O dipanaskan hingga semua air kristalnya menguap. Ternyata, massanya berkurang 36,54%. Jika diketahui Ar Zn = 65, N = 14, O = 16, dan H = 1, tentukan nilai x!
Pembahasan:
Diketahui:
massa kristal Zn(NO3)2.xH2O = 100 % = 100 gram
massa H2O = 36,54% = 36,54 gram
massa Zn(NO3)2 = 100 gram – 36,54 gram = 63,46 gram
Ditanyakan: x = …?
Jawaban:
Jumlah mol Zn(NO3)2 = gram/Mr = 63,46/189 = 0,34
Jumlah mol H2O = gram/Mr = 36,54/18 = 2,03
Perbandingan mol Zn(NO3)2 : H2O = 0,34 : 2,03 = 1 : 6
Jadi, nilai x adalah 6. Sehingga rumus kristalnya adalah Zn(NO3)2.6H2O
Contoh Soal No. 2
Jika hidrat tembaga (II) sulfat (CuSO4.xH2O) dipanaskan, maka massanya berkurang sebanyak 36%. Bagaimana rumus molekul hidrat tersebut? (Ar Cu = 63,5; S = 32; O = 16; H = 1)
Pembahasan:
CuSO4.xH2O(s) → CuSO4(s) + xH2O(g)
Massa H2O = 36% = 36 gram
Massa CuSO4 = 100% – 36% = 64% = 64 gram
Mr CuSO4 = 159,5
Mr H2O = 18
n CuSO4 = gr/Mr = 64/159,5 = 0,4 mol
n H2O = gr/Mr = 36/18 = 2 mol
n CuSO4/koefisien CuSO4 = nH2O/koefisien H2O
0,4/1 = 2/x
x = 5
Jadi, rumus hidrat tembaga (II) sulfat adalah CuSO4.5H2O
Contoh Soal No. 3
Kristal garam natrium karbonat (Na2CO3.xH2O) yang massanya 9,8 gram direaksikan dengan asam klorida sampai habis dengan reaksi:
Na2CO3(s) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2(g)
Ternyata dihasilkan gas CO2 sebanyak 1,12 liter pada keadaan standar (00C, 1atm). Jika diketahui Ar N = 23, C = 12, O = 16, dan H = 1; tentukan jumlah air kristal pada garam natrium karbonat tersebut.
Pembahasan:
n CO2 = 1,12/22,4 = 0,05 mol
Perbandingan koefisien Na2CO3 dengan CO2 adalah sama, sehingga jumlah mol Na2CO3 sama dengan jumlah mol CO2 yaitu 0,05 mol
Mr Na2CO3.xH2O = Mr Na2CO3 + Mr xH2O = (106 + 18x)
n Na2CO3.xH2O = gr/Mr
n . Mr = gr
0,05 . (106 + 18x) = 9,8
5,3 + 0,9x = 9,8
0,9x = 9,8 – 5,3
0,9x = 4,5
x = 4,5/0,9 = 5
Jadi, jumlah air kristal pada garam natrium karbonat tersebut sebanyak 5. Sehingga rumus kimia kristal garam natrium karbonat adalah Na2CO3.5H2O.