Dalam mekanika kuantum, tiga macam bilangan kuantum diperlukan untuk menggambarkan distribusi elektron dalam atom hidrogen dan atom – atom lain. Macam-macam bilangan kuantum tersebut disebut sebagai bilangan kuantum utama, bilangan kuantum azimuth, dan bilangan kuantum magnetik. Ketiga bilangan kuantum tersebut digunakan untuk menggambarkan orbital – orbital atom dan menandai elektron – elektron didalamnya. Adapun bilangan kuantum yang keempat, yaitu bilangan kuantum spin, menggambarkan perilaku elektron tertentu dan melengkapi gambaran tentang elektron dalam atom.
1. Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) bernilai bilangan bulat 1, 2, 3, 4, dan seterusnya. Bilangan kuantum utama berhubungan dengan jarak rata – rata elektron dari inti dalam orbital tertentu, Semakin besar nilai n, semakin besar jarak rata – rata elektron dalam orbital tersebut dari inti dan oleh karena itu semakin besar orbitalnya.
2. Bilangan Kuantum Azimuth (l)
Bilangan kuantum azimuth (l) berhubungan dengan bentuk orbital. Nila bilangan kuantum azimuth (l) berhubungan dengan nilai bilangan kuantum utama (n). Nilai bilangan kuantum azimuth dimulai dari nol (0) sampai (n – 1). Misalnya,
Jika n = 1, hanya ada satu nilai l yang mungkin, yaitu:
l = n – 1 = 1 – 1 = 0
Jika n = 2, maka nilai l adalah:
l = n – 1 = 2 – 1 = 0 dan 1
jika n = 3, maka nilai l adalah:
l = n – 1 = 3 – 1 = 0, 1, dan 2
Nilai – nilai l biasanya ditandai dengan huruf s, p, d, f, …. sebagai berikut:
| l | 0 | 1 | 2 | 3 | 4 | 5 |
| Nama Orbital | s | p | d | f | g | h |
Jika l = 0, kita mempunyai orbital s; jika l = 1 kita mempunyai orbital p; dan seterusnya.
3. Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik menggambarkan orientasi orbital dalam ruang. Di dalam satu subkulit, nilai m bergantung pada nilai bilangan kuantum azimuth.
Jika l = 0, maka m = 0
Jika l = 1, maka m = -1, 0, +1
Jika l = 2, maka m = -2, -1, 0, +1, +2
Jika l = 3, maka m = -3, -2, -1, 0, +1, +2, +3
4. Bilangan kuantum Spin (s)
Menurut teori elektromagnetik, muatan yang berputar pada sumbunya akan menghasilkan medan magnetik, dan gerakannya itulah yang menyebabkan elektron berperilaku seperti magnet.
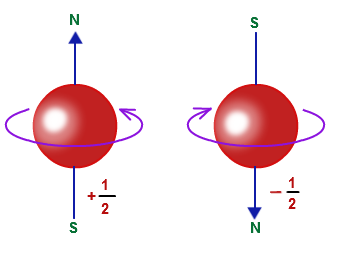
Pada gambar diatas menunjukkan dua kemungkinan gerak spin elektron, yang satu searah jarum jam dan satunya berlawanan dengan arah jarum jam. Sehingga bilangan kuantum spin dapat mempunyai 2 nilai yaitu s = +½ dan s = -½.