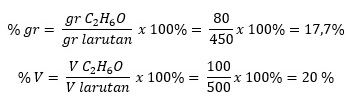Materi Larutan dan Konsentrasi Larutan
Larutan adalah campuran homogen dari dua jenis zat atau lebih. Larutan terdiri dari zat terlarut (solut) dan zat pelarut (solven). Larutan tidak hanya berbentuk cair, tetapi juga berbentuk gas dan padat. Contoh larutan:
- Berbentuk cair = larutan garam, larutan gulu, sirup
- Berbentuk gas = udara
- Berbentuk padat = emas 22 karat
Lantas, bagaimana sifat – sifat larutan? Larutan memiliki sifat – sifat sebagai berikut:
- tidak ada bidang batas antar komponen penyusunnya
- antara partikel zat terlatir dan zat pelarut tidak bisa dibedakan
- komponen yang paling banyak dianggap pelarut.
Berdasarkan jenisnya, larutan terbagi menjadi dua macam yaitu: larutan elektrolit dan non elektrolit.
Larutan elektrolit adalah larutan yang dapat menghantarkan listrik. Contohnya larutan garam dapur, larutan asam asetat, larutan kapur sirih, larutan asam sulfat, air laut, air sungai, dan larutan tawas.
Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Contohnya larutan gula, larutan alkohol, dan larutan urea.
Konsentrasi larutan adalah besaran yang menyatakan jumlah zat terlarut. Konsentrasi larutan dapat dinyatakan dalam molaritas (M), molalitas (m), fraksi mol (X) dan kadar (%).
1. Molaritas (M)
Molaritas adalah jumlah mol zat terlarut dalam 1 liter larutan. Molaritas dirumuskan sebagai berikut:
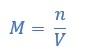
Keterangan;
M = molaritas (M)
n = jumlah mol zat terlarut (mol)
V = volume pelarut (L)
Molaritas larutan juga dapat diketahui dari kadar zat terlarut dalam larutan, dirumuskan sebagai berikut:
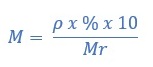
Keterangan;
ρ = massa jenis larutan (kg/L)
% = kadar zat terlarut
Mr = massa molar
Kemolaran larutan dapat diubah dengan ditambahkan zat terlarut atau ditambahkan pelarut dan berlaku rumus pengenceran:
M1 . V1 = M2 . V2
Perhatikan contoh soal menghitung molaritas larutan berikut ini:
4,9 gram H2SO4 dilarutkan dalam 2L air, tentukan:
- Molaritas mula – mula
- Kemolaran jika 100 mL larutan ini ditambah 400 mL air
- Kemolaran jika larutan a dicampur larutan b sampai 4 L
Pembahasan:
1. Molaritas mula – mula
n = gr/Mr = 4,9/98 = 0,05 mol
M = n/V = 0,05/2= 0,025 M
2. Kemolaran jika 100 mL larutan ini ditambah 400 mL air
M1 . V1 = M2 . V2
0,025 . 100 = M2 . 500
M2 = 0,005 M
3. Kemolaran jika larutan 1 dicampur larutan 2 sampai 4 L
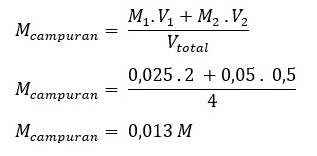
2. Molalitas (m)
Molalitas adalah jumlah mol zat terlarut dalam 1 kg pelarutnya. Molalitas dirumuskan sebagai berikut:
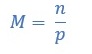
Keterangan;
m = molalitas (m)
n = jumlah mol zat terlarut (mol)
p = massa pelarut (kg)
Contoh soal molalitas:
4 gram NaOH dilarutkan dalam 400 gram air, tentukan molalitas larutan tersebut!
Pembahasan:
Diketahui:
gr NaOH = 4 gr; Mr NaOH = 40
p = 400 gr = 0,4 kg
Ditanyakan: m…?
Jawaban:
n = gr/Mr = 4/40 = 0,1 mol
m = n/p = 0,1/0,4 = 0,25 m
3. Fraksi Mol (X)
Fraksi mol adalah perbandingan jumlah mol zat X dengan mol total yang ada dalam larutan. Fraksi mol dirumuskan sebagai berikut:
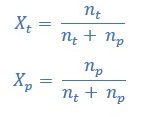
Xt + Xp = 1
Keterangan;
Xt = fraksi mol zat terlarut
Xp = fraksi mol zat pelarut
nt = mol zat terlarut
np = mol zat pelarut
Perhatikan contoh soal fraksi mol berikut ini:
Sebanyak 7,1 gram Na2SO4 (Mr = 142) dimasukkan ke dalam 36 gram air. Hitunglah fraksi mol Na2SO4, H2O, Na+, dan SO42-.
Pembahasan:
n Na2SO4 = 7,1/142 = 0,05 mol
n H2O = 36/18 = 2 mol
n Na+ = 0,1 mol
n SO42- = 0,05 mol
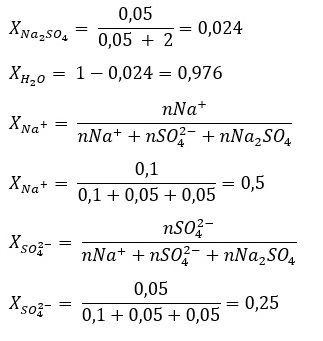
4. Kadar Zat Terlarut (%)
Kadar zat terlarut dibagi menjadi dua, yaitu kadar (%) massa dan kadar (%) volume yang dirumuskan sebagai berikut:
% Massa
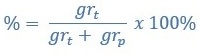
Atau
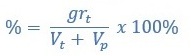
Keterangan;
% = kadar zat (%)
grt = massa zat terlarut
grp = massa zat perlarut
Vt = volume zat terlarut
Vt = volume zat pelarut
% Volume
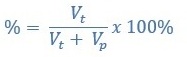
Atau
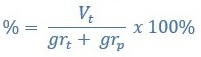
Perhatikan contoh soal menentukan kadar zat berikut ini:
Sebanyak 100 mL C2H6O (ρ = 0,8 gr/mL) ditambahkan ke dalam 400 mL air. Jika ρ larutan = 0,9 gr/mL, tentukan kadar massa dan volume zat terlarut!
Pembahasan:
Diketahui:
V C2H6O = 100 mL
gr C2H6O = 0,8 x 100 = 80 gr
V larutan = 500 mL
gr larutan = 0,9 x 500 = 450 gr
Ditanyakan: kadar massa dan kadar volume …?
Jawaban: