Sifat Fisika Alkana
- Alkana yang memiliki berat molekul rendah yaitu metana, etana, propana, dan butana pada suhu kamar dan tekanan atmosfer berwujud gas, alkana yang memiliki 5-17 atom karbon berwujud cair dan selebihnya berwujud padat.
- Alkana merupakan senyawa nonpolar sehingga sukar larut dalam air tetapi cenderung larut pada pelarut-pelarut yang nonpolar seperti eter. Jika alkana ditambahkan pada air alkana akan berada pada lapisan atas, hal ini disebabkan adanya perbedaan massa jenis antara air dan alkana. Sebagian besar alkana memiliki massa jenis lebih kecil dari massa jenis air. Karena alkana merupakan senyawa nonpolar sehingga alkana yang berwujud cair pada suhu kamar merupakan pelarut yang baik untuk senyawa-senyawa kovalen.
- Untuk alkana-alkana yang berantai lurus titik leleh dan titik didih makin tinggi seiring bertambahnya massa molekul molekul. Pada molekul-molekul alkana terjadi gaya van der Wals. Oleh karena itu alkana memiliki titik leleh dan titik didih yang lebih rendah dibanding senyawa semipolar atau senyawa polar dengan berat molekul yang hampir sama.
Sifat kimia Alkana
1. Reaksi Oksidasi
Alkana merupakan senyawa nonpolar yang tidak bereaksi dengan sebagian besar pereaksi. Hal ini disebabkan alkana memiliki ikatan sigma yang kuat antar atom karbon.
Pada kondisi tertentu alkana dapat bereaksi dengan oksigen
Apabila jumlah oksigen tersedia cukup memadai alkana akan teroksidasi sempurna menjadi karbon dioksida dan uap air serta pelepasan sejumlah energi panas. Apabila jumlah oksigen yang tersedia tidak mencukupi, hasil reaksi yang diperoleh berupa karbon monooksida dan uap air.
CH4 + 2O2 → CO2 + 2H2 + 212,8 kkal/mol
C4H10 + 2O2 → CO2 + H2O + 688,0 kkal/mol
2. Alkana dapat bereaksi dengan halogen dikatalisis oleh panas atau sinar ultraviolet. Dari reaksi tersebut terjadi pergantian 1 atom H dari alkana terkait. Namun apabila halogen yang tersedia cukup memadai atau berlebih, maka terjadi pergantian lebih dari satu atom bahkan semua atom H digantikan oleh halogen. Berdasarkan penelitian laju pergantian atom H sebagai berikut H3 > H2 > H1. Reaksi pergantian atom dalam suatu senyawa disebut reaksi
Contoh : CH4 + Cl2 →CH3Cl + HCl
3. Reaksi Perengkahan
Reaksi perengkahan termasuk reaksi eliminasi, reaksi ini terjadi pada suhu yang tinggi atau menggunakan katalis.
C2H6 →C2H4 +H2
Isomer
Isomer adalah suatu keadaan suatu senyawa dengan rumus molekul sama tetapi rumus strukturnya berbeda.
Isomer alkana merupakan isomer rangka atau struktur
Contoh : isomer n-butana H3C-CH2-CH2-CH3
2-metil propane H3C-CH(CH3)-CH3
Kegunaan alkana, sebagai :
- Bahan bakar
- Pelarut
- Sumber hidrogen
- Pelumas
- Bahan baku untuk senyawa organik lain
- Bahan baku industri
Alkena
Alkena merupakan senyawa hidrokarbon tidak jenuh.
Rumus molekul CnH2n.
Penamaan alkena tidak jauh berbeda dengan senyawa alkana.
- Sama seperti senyawa alkana, rantai induk pada alkena juga merupakan rantai terpanjang, akan tetapi rantai induk harus mengandung ikatan rangkap. Jika terdapat rantai yang lebih panjang tetapi tidak mengandung ikatan rangkap, maka itu bukanlah rantai induk.
- Penomoran dimulai dari salah satu ujung rantai sedemikian rupa sehingga ikatan rangkap mendapat nomor terkecil. Posisi ikatan rangkap ditunjukkan dengan awalan angka yaitu nomor dari atom karbon berikatan rangkap yang paling pinggir (nomor terkecil).
- Penulisan cabang-cabang pada alkena sama dengan penulisan cabang pada alkana. Jika sudah mahir dalam penamaan senyawa alkana, maka penamaan alkena pasti tidak sulit.
Contoh menentukan nama Alkena
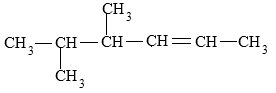
1. Tulislah nama IUPAC dan rumus molekul dari senyawa alkena berikut ini :
Pembahasan
Dari gambar di atas diperoleh :
⇒ rantai induk = 6 = heksena
⇒ posisi ikatan rangkap = 2
⇒ rantai cabang = 2 CH3 (dimetil)
⇒ posisi cabang = 4,5.
⇒ nama = 4,5−dimetil−2−heksena
⇒rumus molekul = C8H16.
Sifat Alkena
Sifat fisis alkena sama dengan sifat fisis alkana
Sifat kimia Alkena
Alkena mempunyai sifat-sifat kimia yang berbeda dengan alkana. Alkena memiliki ikatan rangkap dua pada rantai karbonnya. Alkena lebih reaktif daripada alkana karena adanya ikatan rangkap. Alkena dapat mengalami reaksi: reaksi pembakaran, reaksi adisi, reaksi substitusi dan polimerisasi.
Rekasi pembakaran
Alkena, seperti alkana, sangat mudah terbakar. Alkena dapat dibakar dengan api untuk menghasilkan karbon dioksida dan air. Reaksi pembakaran alkena termasuk eksotermik.
CnH2n + 3n/2 O2(g) → nCO2 + nH2O + Panas
Karena terangnya cahaya api, alkena lebih rendah dapat digunakan sebagai illuminants.
Reaksi Adisi
Elektron p dari ikatan karbon-karbon ganda yang tersedia untuk elektrofil (spesies apapun mencari elektron). Dengan demikian, reaksi yang ditunjukkan oleh penambahan alkena sebenarnya elektrofilik reaksi adisi. Beberapa reaksi adisi berlangsung melalui mekanisme radikal bebas.
Adisi hidrogen
Alkena menambah hidrogen dengan adanya platinum atau nikel katalis, untuk membentuk alkana. Reaksi disebut sebagai hidrogenasi, adalah reaksi eksotermis.
CnH2n + H2(g) → CnH2n+2 + Panas
Reaksi ini dikenal sebagai Reaksi reduksi Sabatier-Senderens.
CH2 = CH2 + H2 → CH3-CH3 +132,2kJ
etena etana
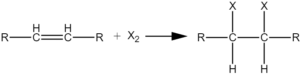
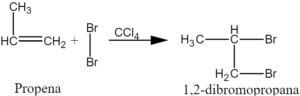
Adisi halogen
Alkena bereaksi dengan halogen membentuk dihaloalkanes. Urutan reaktivitas adalah, klorin> brom> iodin. Cukup mencampurkan dua reaktan, biasanya dalam pelarut inert seperti karbon tetraklorida, terbaik melakukan reaksi.
Contohnya:
Adisi bromin berguna untuk mendeteksi ikatan rangkap karbon-karbon. Ketika larutan 5% dari bromin dalam karbon tetraklorida ditambahkan ke alkena. Hal ini menunjukkan adanya ikatan ganda dalam molekul. Tes ini disebut ‘test bromin’.
Mekanisme adisi halogen
Penambahan halogen ke ikatan rangkap terjadi melalui langkah-langkah berikut.
Contoh pada etena:
Etena mengalami efek elektromerik