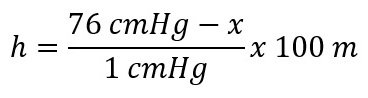Dalam kehidupan sehari-hari, selain ada tekanan zat padat dan zat cair juga ada tekanan zat gas. Tekanan zat gas dikelompokkan menjadi dua, yaitu: materi tekanan gas pada ruang terbuka dan materi tekanan gas pada ruang tertutup.
1. Tekanan Gas pada Ruang Terbuka atau Tekanan Udara

Besarnya tekanan gas pada ruang terbuka di atas permukaan bumi berbeda-beda. Setiap kenaikan 100 m dari permukaan laut, tekanan udara berkurang 1 cmHg. Hal tersebut disebabkan karena semakin renggang kerapan udara, semakin kecil pula tekanan udaranya. Hubungan antara ketinggian tempat dan tekanan udara dirumuskan sebagai berikut:
h = ketinggian tempat dari permukaan laut (m)
x = tekanan tempat dari permukaan laut (cmHg)
Contoh Soal:
Diketahui kota A terletak pada ketinggian 700 m di atas permukaan air laut. Tentukan tekanan udara di kota A!
Pembahasan:
Diketahui:
h = 700 m
Ditanyakan: x = …?
Jawaban:
h . 1 cmHg = (76 cmHg – x) . 100 m
700 m . 1 cmHg = (76 cmHg – x) . 100 m
700 cmHg = 7600 cmHg – 100 x
100 x = 7600 cmHg – 700 cmHg
100 x = 6900 cmHg
x = 6900 cmHg/100 = 69 cmHg
2. Tekanan Gas pada Ruang Tertutup
Seorang ilmuan berkebangsaan Inggris bernama Robert Boyle, menyatakan sebuah teori dan dikenal sebagai hukum Boyle yang berbunyi:
“Pada suhu yang tetap, hasil kali antara tekanan dan volume gas dalam ruang tertutup selalu tetap”.
Secara matematis Hukum Boyle dituliskan sebagai berikut:
P1 . V1 = P2 . V2
Keterangan:
P1 = Tekanan udara awal (Pa)
V1 = Volume udara awal (m3)
P2 = Tekanan udara akhir (pa)
V2 = Volume udara akhir (m3)
Namun, hukum Boyle hanya berlaku jika dalam ruang tertutup tersebut tidak terjadi raksi kimia dan tidak terjadi perubahan wujud zat. Penerapan hukum Boyle dalam kehidupan sehari – hari yaitu pada pompa sepeda, pompa air, pipet, dan pipa siphon.
Contoh Soal:
Di dalam sebuah bejana tertutup terdapat gas yang mempunyai tekanan 2 atm dan volume 1 liter. Jika tekanan gas menjadi 4 atm maka volume gas menjadi …
Pembahasan:
Diketahui:
P1 = 2 atm = 2 x 105 Pa
P2 = 4 atm = 4 x 105 Pa
V1 = 1 L = 1 x 10-3 m3
Ditanyakan: V2 = …?
Jawaban:
P1 . V1 = P2 . V2
2 x 105 Pa . 1 x 10-3 m3 = 4 x 105 Pa . V2
1 x 102 m3 = 2 x 105 . V2
V2 = ½ x 10(2-5) m3
V2 = 0,5 x 10-3 m3
V2 = 0,5 L