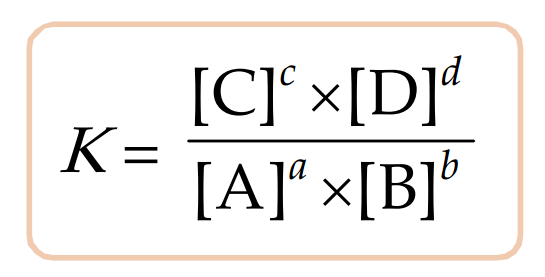Tetapan kesetimbangan kimia merupakan angka yang menunjukkan perbandingan secara kuantitatif antara produk dengan reaktan. Secara umum reaksi kesetimbangan dapat dituliskan sebagai berikut
aA + bB ⇌ cC + dD
Sesuai dengan prinsip Le Chatelier pada pelajaran sebelumnya, jika dalam reaksi keetimbangan dilakukan aksi, maka kesetimbangan akan bergeser dan sekaligus mengubah komposisi zat-zat yang ada untuk kembali mencapai kesetimbangan.
Secara umum dapat dikatakan bahwa tetapan kesetimbangan merupakan perbandingan hasil kali molaritas reaktan dengan hasil kali molaritas produk yang masing-masing dipangkatkan dengan koefisiennya.
Keterangan:
K = tetapan kesetimbangan
[A] = molaritas zat A ……(M)
[B] = molaritas zat B ……(M)
[C] = molaritas zat B ……(M)
[D] = molaritas zat B ……(M)
tetapan kesetimbangan (K), sering juga dituliskan sebagai Kc.
Perhatikan contoh soal tetapan kesetimbangan kimia berikut:
Satu liter campuran gas pada suhu 1000C pada keadaan setimbang mengandung 0,0045 mol dinitrogen tetraoksida dan 0,03 mol nitrogen dioksida.
a. Tuliskan rumus tetapan kesetimbangan gas tersebut!
b. Hitung tetapan kesetimbangan gas tersebut!
Pembahasan
Diketahui:
n N2O4 = 0,0045 mol
n NO2 = 0,03 mol
T = 100 C
V = 1 l
Ditanya:
a. Rumus tetapan kesetimbangan gas?
b. Tetapan kesetimbangan gas?
Jawab:
Kita tuliskan persamaan reaksinya terlebih dahulu
N2O4(g) ⇌ NO2(g)
Selanjutnya kita setarakan reaksinya
c(g) ⇌ 2NO2(g)
a. Rumus tetapan kesetimbangan gas
Kc = [NO2]2 : [NO2]2
b. Tetapan kesetimbangan gas
Kc = [NO2]2 : [NO2]2
Kc = 0,032 : 0,0045
Kc = 0,2 mol/L
Jadi, tetapan kesetimbangan gas tersebut sebesar 0,2 mol/L.