Soal SBMPTN saintek totalnya ada 60 soal terdiri atas soal matematika, soal fisika, soal kimia, dan soal biologi dengan masing-masing jumlahnya ada 15 butir soal. Pembahasan soal SBMPTN 2017 Saintek (kimia) terdapat pada nomor 31 – 45, sehingga kini kita akan melakukan pembahasan soal SBMPTN 2017 saintek nomor 31 – 45.
Pembahasan Soal SBMPTN 2017 Saintek Nomor 31-35
Soal No. 31
Nomor atom R adalah 33. Konfigurasi elektron ion R3− adalah ….
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 5s2 4d6
B. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 5s1
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d8 4p6 5s2
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
E. 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
Jawaban: D
Pembahasan:
Atom R memiliki konfigurasi sebagai berikut:
33R = [Ar] 4s2 3d10 4p3
Sehingga konfigurasi atom R-3 adalah sebagai berikut:
33R = [Ar] 4s2 3d10 4p6
Soal No. 32
Orbital hibrida yang digunakan oleh atom B (nomor atom = 5) untuk berikatan pada molekul BF3 adalah ….
A. sp
B. sp2
C. sp3
D. dsp2
E. sp2d
Jawaban: B
Pembahasan:
Konfigurasi elektron atom B adalah sebagai berikut:
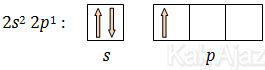
5B = 1s2 2s2 2p1
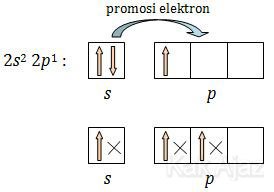
Sehingga dapat kita ketahui bahwa elektron valensi B adalah 2s2 2p1 yang dapat kita gambarkan sebagai berikut:
Dalam molekul BF3 satu atom B berikatan dengan 3 atom F. Proses ikatan berlangsung dengan eksitasi 1 elektron B dari orbital 2s ke orbital 2p. Kemudian 3 elektron atom F masuk ke dalam orbital 2s dan 2p yang menyebabkan terbentuknya orbital hibrida sp2. Jika digambarkan prosesnya sebagai berikut:
Soal No. 33
Perhatikan persamaan reaksi (belum setara) berikut:
M3O4(s) + CO(g) → MO(s) + CO2(g)
Jika 2,8 g CO (Ar O = 16; C = 12) bereaksi sempurna menghasilkan 21,6 g MO, Ar M adalah …
A. 14
B. 27
C. 56
D. 72
E. 103
Jawaban: C
Pembahasan:
Kita setarakan terlebih dahulu persamaan reaksi kimia di atas, sehingga diperoleh reaksi setara sebagai berikut:
M3O4(s) + CO(g) → 3MO(s) + CO2(g)
Terlebih dulu kita cari mol CO
n CO = gr CO / Mr CO
n CO = 2,8 / 28 = 0,1 mol
Selanjutnya kita cari jumlah mol MO, karena koefisien MO 3 kali lebih besar dari koefisien CO maka jumlah mol MO juga 3 kali lebih besar daripada jumlah mol CO. Sehingga,
n MO = 3 x n CO
n MO = 3 x 0,1 mol = 0,3 mol
setelah ketemu jumlah mol MO, kini kita bisa menjadi Mr MO dengan cara:
n MO = gr MO /Mr MO
Mr MO = gr MO / n MO
Mr MO = 21,6 / 0,3 = 72
Selanjutnya, nilai Mr MO kita gunakan untuk menentukan Ar M.
Mr MO = Ar M + Ar O
Ar M = Mr MO – Ar O
Ar M = 72 – 16 = 56
Soal No. 34
Sebanyak 1 mmol Mg(OH)2 direaksikan dengan 5 mL HCl 0,5 M menurut reaksi (belum setara) berikut:
Mg(OH)2(s) + HCl(aq) → MgCl2(aq) + H2O(l)
Konsentrasi HCl setelah reaksi adalah ….
A. 0,050 M
B. 0,075 M
C. 0,100 M
D. 0,125 M
E. 0,500 M
Jawaban: C
Pembahasan:
n Mg(OH)2 = 1 mmol
n HCl = M x V = 0,5 x 5 = 2,5 mmol
Mg(OH)2 | + | 2HCl | → | MgCl2 | + | 2H2O | |
Awal | 1 | 2,5 | – | – | |||
Reaksi | 1 | 2 | 1 | 2 | |||
Sisa | – | 0,5 | 1 | 2 |
[HCl] = n sisa / V total
[HCl] = 0,5 / 5 = 0,1 M
Soal No. 35
Sebuah tabung bervolume tetap berisi 6 g gas H2 (Ar H = 1) memiliki tekanan 12 atm pada temperatur tertentu. Ke dalam tabung tersebut ditambahkan gas Ne (Ar Ne = 20) sehingga tekanannya menjadi 40 atm tanpa mengubah temperatur. Massa gas total di dalam tabung tersebut adalah ….
A. 26 g
B. 56 g
C. 140 g
D. 146 g
E. 286 g
Jawaban: D
Pembahasan:
Diketahui:
P H2 = 12 atm
P Ne = 40 – 12 = 28 atm
n H2 = gr H2 / Mr H2
n H2 = 6 /2 = 3 mol
n Ne = gr Ne/Mr Ne
n Ne = gr Ne / 20
Ditanya: gr total ….?
Jawaban:
Kita cari mol Ne terlebih dahulu untuk menentukan massa Ne, dengan rumus:
P H2 : P Ne = n H2 : n Ne
n Ne = n H2 x P Ne : P H2
n Ne = 3 x 28 : 12 = 7 mol
Setelah ketemu mol Ne sebesar 7 mol, sekarang kita bisa mencari massa Ne, dengan rumus:
n Ne = gr Ne / 20
gr Ne = 7 x 20 = 140 gr
Langkah terakhir, kita jumlahkan massa H2 + massa Ne untuk mendapatkan massa totalnya.
gr total = gr H2 + gr Ne
gr total = 6 + 140 = 146 gr