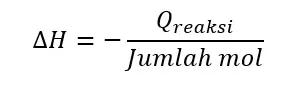Penentuan perubahan entalpi dengan kalorimeter disebut kalorimetri. Data reaksi yang terdapat pada tabel-tabel umumnya ditentukan secara kalorimetris. Kalorimeter adalah suatu sistem terisolasi (tidak ada pertukaran materi maupun energi dengan lingkungan di luar kalorimeter). Dengan demikian, semua kalor yang dibebaskan oleh reaksi yang terjadi di dalam kalorimeter, tidak ada yang terbuang ke luar kalorimeter.
Kalorimeter sederhana dapat dibuat dari dua gelas gabus (styrofoam) atau plastik yang dilengkapi dengan termometer dan pengaduk. Gabus dan plastik bersifat isolator (tidak menyerap kalor) sehingga selama reaksi berlangsung dianggap tidak ada kalor yang hilang.
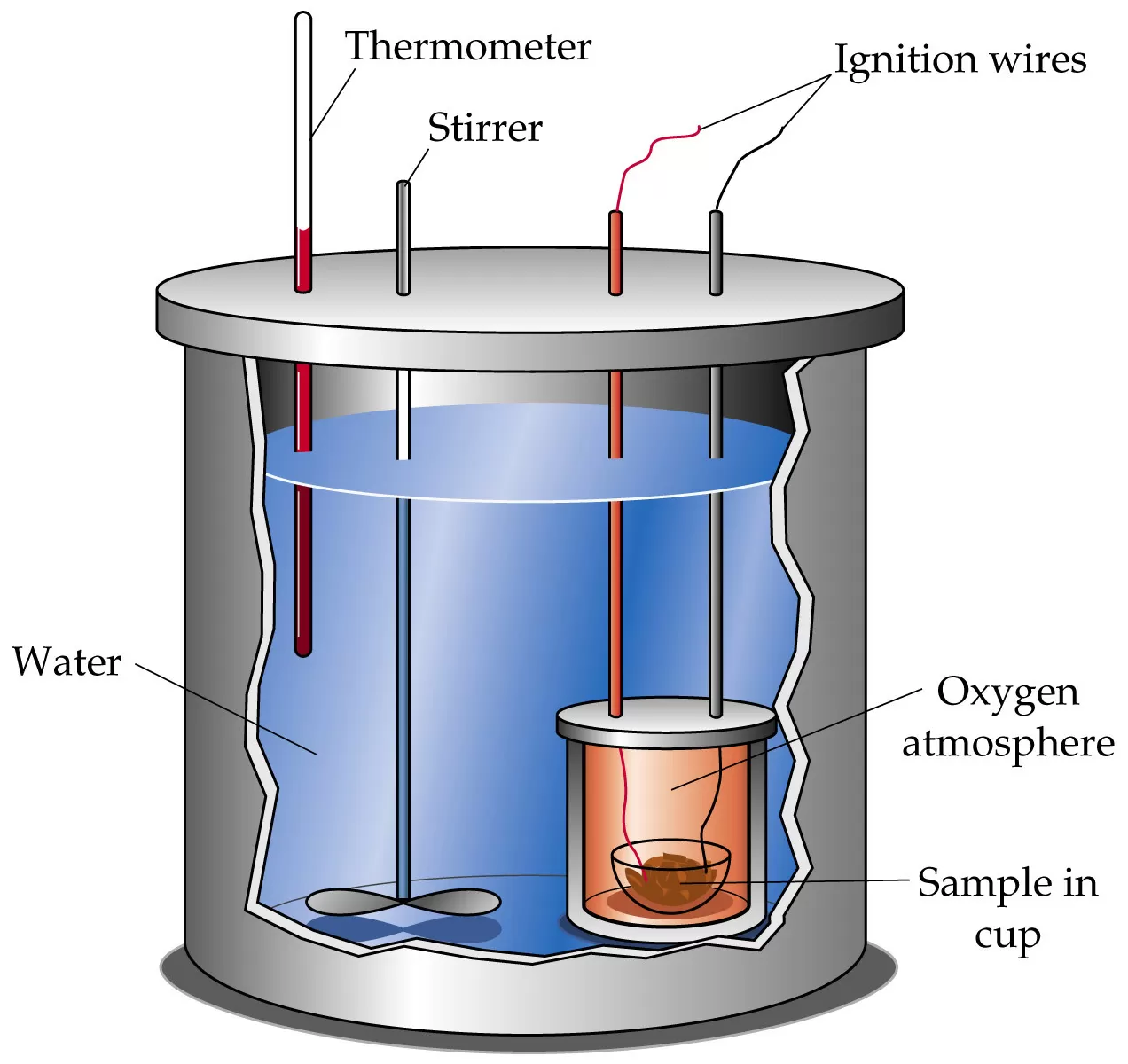
Untuk reaksi yang melibatkan gas, seperti pada reaksi pembakaran, kalorimeter yang biasa digunakan disebut kalorimeter bom. Pada kalorimeter bom, reaksi berlangsung dalam sebuah bom (wadah yang terbut dari baja) yang dibenamkan di dalam air dalam bejana kedap panas.
Kalorimeter bom dirancang secara khusus sehingga sistem berada dalam keadaan terisolasi. Oleh karena itu, selama reaksi berlangsung dianggap tidak ada kalor yang hilang.
Cara Kera Kalorimeter Bom:
- Susun alat kalorimeter
- Isi gelas kimia dengan 50 mL NaOH
- Isi gelas kimia dengan 50 mL HCl 0,1 M. Ukur dan catat suhu setiap larutan
- Tuangkan 100 mL NaOH 1 M ke dalam kalorimeter, disusul 100 mL HCl M
- Tutup kalorimeter dengan karet penyumbat lalu aduk campuran larutan
- Catat suhu campuran larutan
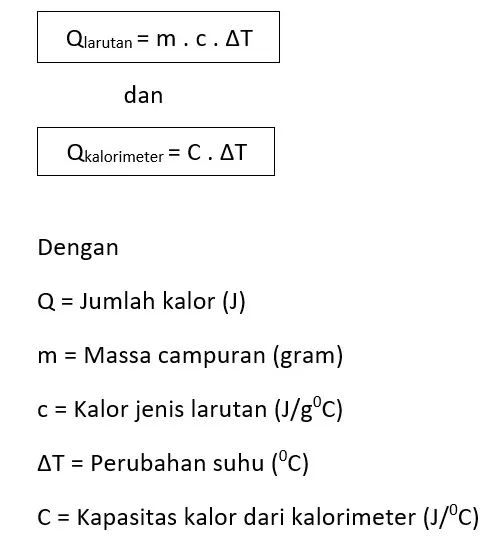
Dengan mengukur kenaikan suhu di dalam kalorimeter, kita dapat menentukan jumlah kalor yang diserap oleh air serta perangkat kalorimeter berdasarkan rumus:
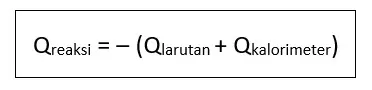
Karena energi tidak dapat diciptakan atau dimusnahkan, maka kalor reaksi sama dengan kalor yang diserap oleh air (larutan) dan kalorimeter, tetapi tandanya berbeda.
Perubahan entalpi dapat ditentukan dengan rumus:
Keterangan:
ΔH = Perubahan entalpi (kJ/mol)
Contoh Soal:
Sebanyak 7,5 gram LiOH (Ar Li = 7, O = 16, H = 1) dimasukkan ke dalam kalorimeter yang berisi 120 gram air. Setelah kristal LiOH itu larut, ternyata suhu kalorimeter beserta isinya naik dari 24°C menjadi 35°C. Kalor jenis larutan = 4,2 J/g°C dan kapasitas kalor kalorimeter = 12 J/°C. Tentukan besarnya entalpi pelarutan LiOH dalam air sesuai persamaan reaksi:
LiOH(s) → Li+(aq) + OH–(aq) ∆H = ?
Pembahasan:
Diketahui:
Massa campuran = massa LiOH + massa air = 7,5 gram + 120 gram = 127,5 gram
ΔT = 35°C – 24°C = 11°C
c = 4,2 J/g°C
C = 12 J/°C
Ditanyakan: ΔH = ….?
Jawaban:
Q larutan = m x c x ΔT
Q larutan = 127,5 x 4,2 x 11 = 5.890,5
Q kalorimeter = C x ΔT
Q kalorimeter = 12 x 11 = 132 J
Q reaksi = – (Q larutan + Q kalorimeter)
Q reaksi = – (5.890,5 + 132)
Q reaksi = – 6.022,5 J = -6,0225 kJ
Jumlah mol LiOH = gr/Mr = 7,5/24 = 0,3125 mol
ΔH = Q reaksi /Jumlah mol = -6,0225 kJ/0,3125 mol = -19,272 kJ/mol
Persamaan reaksi:
LiOH(s) → Li+(aq) + OH–(aq) ∆H = -19,272 kJ/mol