Energi ionisasi adalah energi yang diperlukan untuk mengionkan satu mol atom dalam keadaan gas. Dalam satu periode pada tabel periodik unsur, energi ionisasi cenderung meningkat sepanjang periode dari kiri ke kanan.
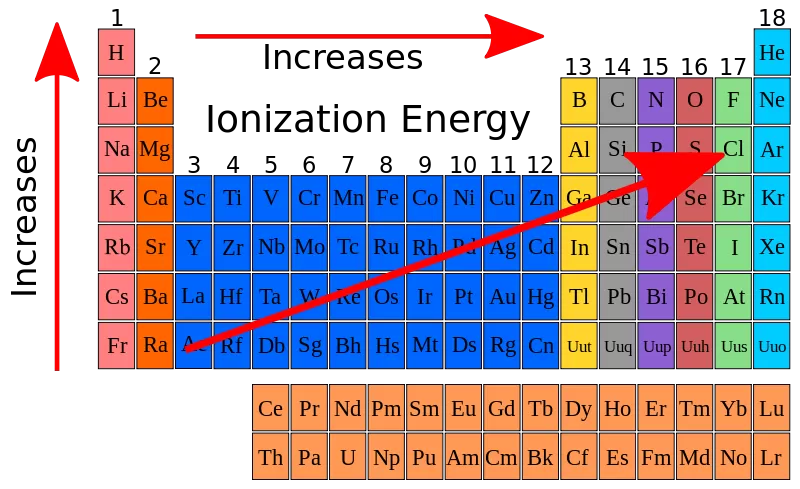
Pada dasarnya, energi ionisasi meningkat karena:
- Jumlah proton (zat inti) meningkat: Saat kita bergerak dari kiri ke kanan dalam satu periode, jumlah proton dalam inti atom juga meningkat. Jumlah proton yang lebih besar menarik elektron-elektron lebih erat, sehingga diperlukan energi yang lebih besar untuk melepaskan satu elektron dari atom tersebut.
- Ukuran atom mengecil: Meskipun jumlah lapisan elektron (kulit) dalam atom juga bertambah sepanjang periode, peningkatan jumlah proton lebih dominan. Oleh karena itu, meskipun ada lebih banyak kulit elektron, ukuran atom keseluruhan mengecil karena gaya tarik proton yang lebih besar.
Dengan kombinasi faktor-faktor tersebut, energi ionisasi cenderung meningkat sepanjang satu periode. Namun, ada pengecualian dalam beberapa kasus di mana terjadi penurunan kecil di energi ionisasi antara dua unsur yang berdekatan dalam satu periode, seperti pada transisi antara gas mulia dan gas alkali. Ini disebabkan oleh konfigurasi elektron yang lebih stabil pada gas mulia, yang membuatnya lebih sulit untuk melepaskan elektron tambahan.