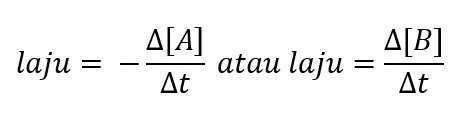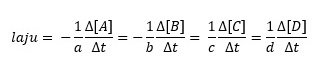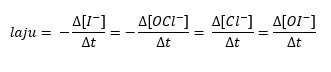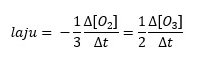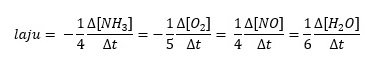Laju reaksi mengukur seberapa cepat reaktan habis bereaksi atau seberapa cepat produk terbentuk. Persamaan laju reaksi dinyatakan sebagai perbandingan perubahan konsentrasi terhadap waktu. Kita telah mengetahui bahwa setiap reaksi dapat dinyatakan dengan persamaan umum:
Reaktan → produk
Persamaan ini memberitahu kita bahwa selama berlangsungnya suatu reaksi, molekul reaktan bereaksi sedangkan molekul produk terbentuk. Sebagai hasilnya, kita dapat mengamati jalannya reaksi dengan cara menurunnya konsentrasi reaktan atau meningkatnya konsentrasi produk.
Sebagai contoh, jika kita mempunyai molekul A diubah menjadi molekul B maka persamaan reaksinya akan menjadi sebagai berikut;
A → B
Secara umum, jika kita akan menentukan laju reaksi dalam reaksi di atas kita dapat menyatakan persamaan laju reaksinya sebagai berikut:
dengan ∆[A] dan ∆[B] adalah perubahan konsentrasi (dalam molaritas) selama selang waktu ∆t. Karena konsentrasi A menurun selama selang waktu ∆t, sehingga ∆[A] dinyatakan sebagai kuantitas negatif. Karena laju reaksi merupakan kuantitas positif, maka tanda minus diperlukan dalam rumus laju agar laju reaksinya posisif. Sebaliknya, laju pembentukan produk tidak memerlukan tanda negatif karena konsentrasi ∆[B] meningkat selama selang waktu ∆t, sehingga ∆[B] dinyatakan sebagai kuantitis positif.
Untuk reaksi yang lebih rumit, kita harus berhati-hati dalam menuliskan rumus laju reaksi. Perhatikan contoh laju reaksi berikut. Misal, reaksi
2A → B
2 mol A menghilang untuk membentuk 1 mol B, dengan kata lain laju hilangnya A adalah dua kali lebih cepat dibandingkan laju terbentuknya B. Kita menuliskan laju reaksinya sebagai berikut,
Bagaimana jika reaksinya itu lebih dari satu molekul atau reaksi pencampuran?
jika reaksinya lebih dari satu molekul, misalnya kita mempunyai reaksi
aA + bB → cC + dD
maka lajunya dapat kita hitung dengan rumus
Sampai disini kita pasti masih bingung, mari kita simak contoh laju reaksi berikut ini:
Tuliskan rumus laju untuk reaksi-reaksi berikut ini ditinjau dari hilangnya reaktan atau munculnya produk:
- I–(aq) + OCl–(aq) → Cl–(aq) + OI–(aq)
- 3O2(g) → 2O3(g)
- 4NH3(g) + 5O2(g) → 4NO(g) + 6H2(g)
Jawab:
1. Karena setiap koefisien stoikiometriknya adalah 1, maka
2. Karena koefisien stoikiometriknya adalah 3 dan 2, maka
3. Dalam reaksi ini,