Teori atom telah mengalami perkembangan sepanjang waktu berkat kontribusi berbagai ilmuwan terkemuka. Berikut adalah ringkasan persamaan dan perbedaan teori atom menurut para ahli utama: Dalton, Thomson, Rutherford, Bohr, dan Mekanika Kuantum.
1. Teori Atom Dalton
Persamaan:
- Atom adalah partikel dasar materi.
- Atom bersifat indivisible (tidak dapat dibagi lagi).
Perbedaan:
- Dalton menganggap atom sebagai bola padat dan tak berstruktur, tanpa komponen internal yang lebih kecil.
- Tidak mempertimbangkan adanya subatom atau partikel bermuatan (seperti proton, neutron, atau elektron) di dalam atom.
- Model atom ini terlalu sederhana dan kurang akurat untuk menjelaskan sifat-sifat atom yang lebih mendalam.
2. Teori Atom Thomson
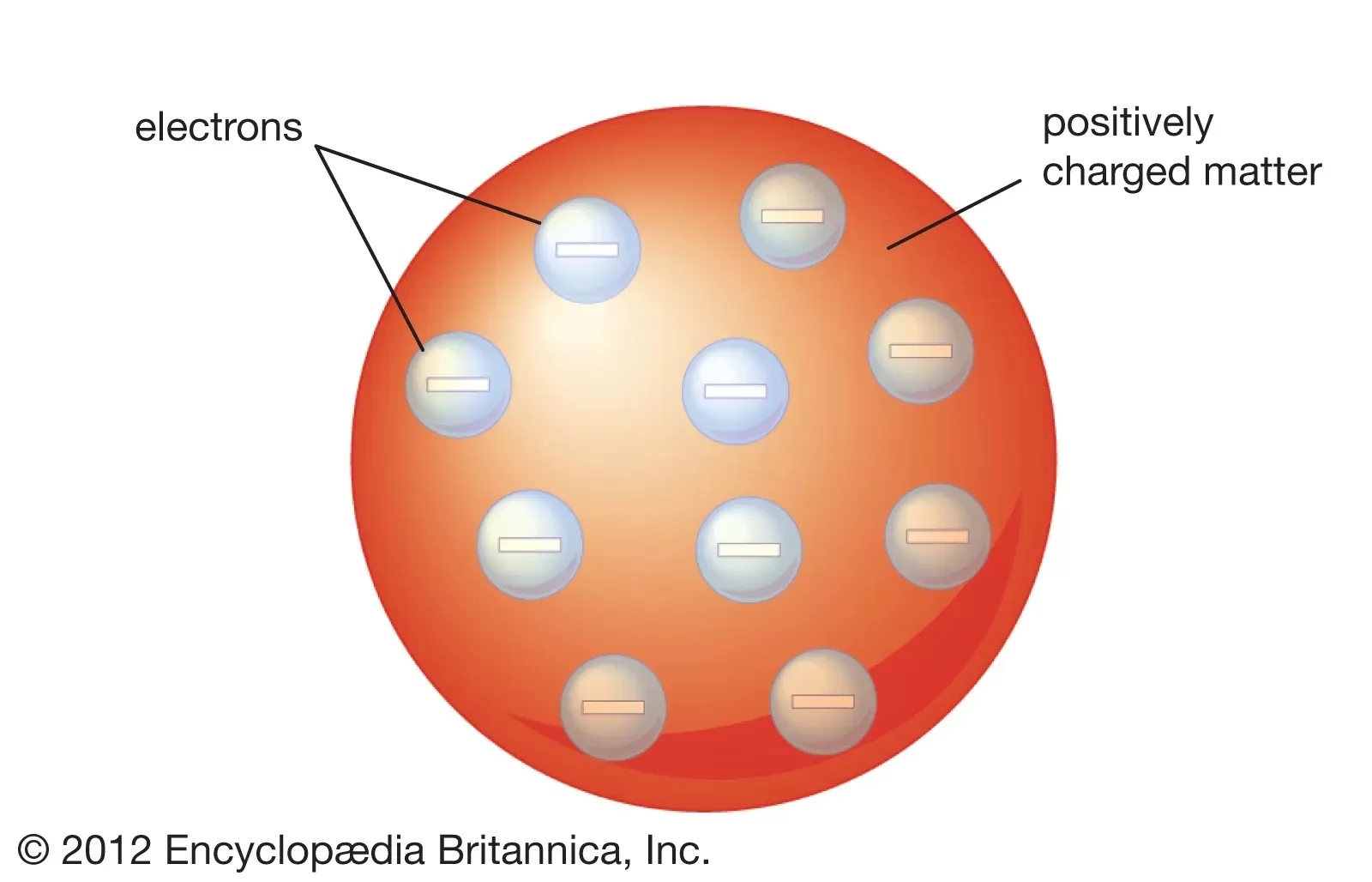
Persamaan:
- Atom terdiri dari partikel subatom yang bermuatan positif dan negatif.
- Elektron adalah partikel subatomik pertama yang ditemukan dan bermuatan negatif.
Perbedaan:
- Thomson mengemukakan model “kue kismis” atau “plum pudding,” di mana elektron tersebar dalam suatu bola positif yang homogen.
- Tidak mempertimbangkan adanya partikel bermuatan positif lainnya selain elektron dalam struktur atom.
3. Teori Atom Rutherford
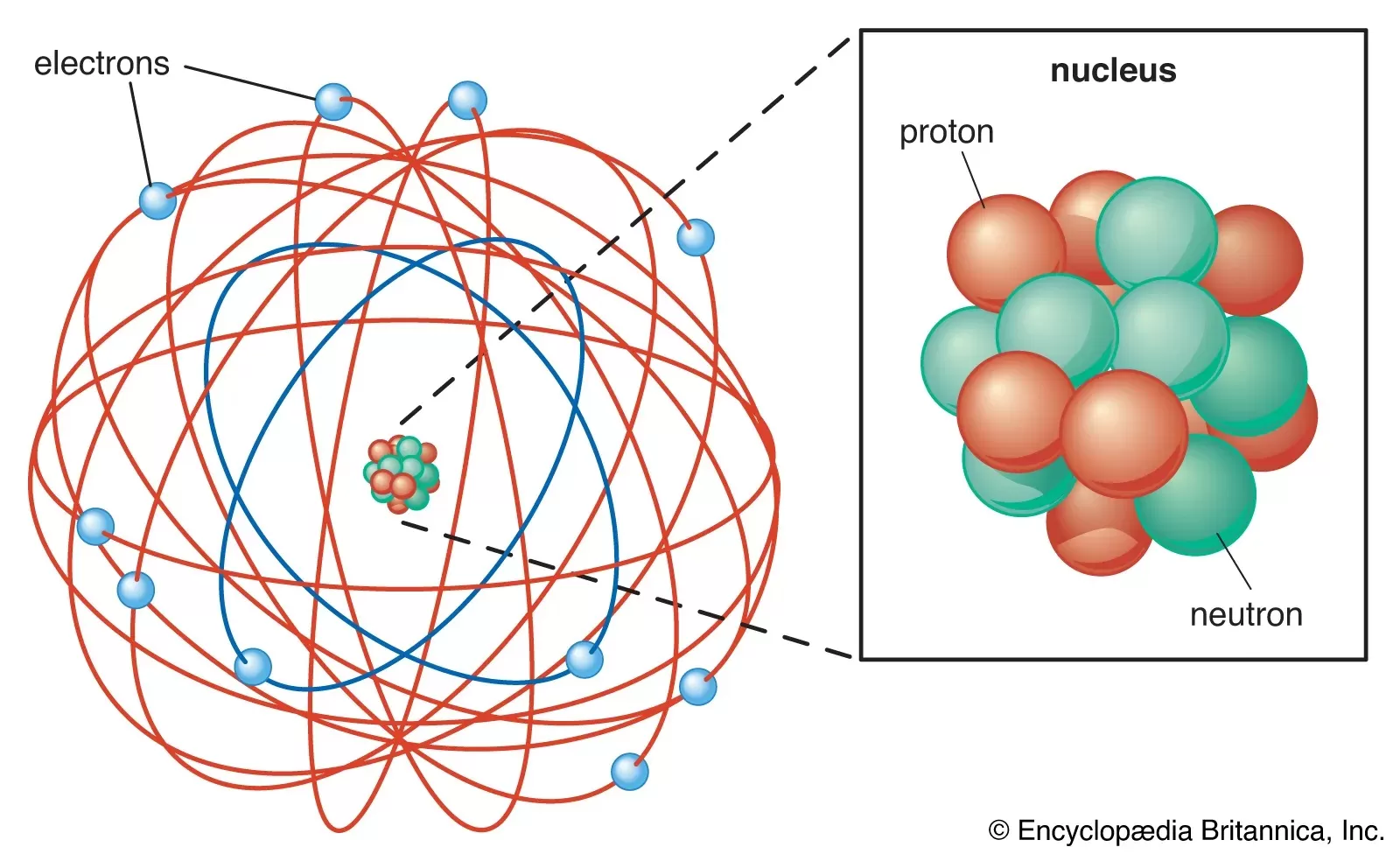
Persamaan:
- Atom memiliki inti yang kecil dan bermuatan positif.
- Elektron mengorbit di sekitar inti atom.
Perbedaan:
- Melalui eksperimen hamburan partikel alfa, Rutherford menemukan bahwa sebagian besar massa atom terkonsentrasi dalam inti kecil, sementara sebagian besar ruang atom hampir kosong.
- Model Rutherford menyiratkan bahwa elektron bergerak dalam orbit mengelilingi inti, tetapi model ini tidak menjelaskan secara tepat perilaku spektrum garis atom.
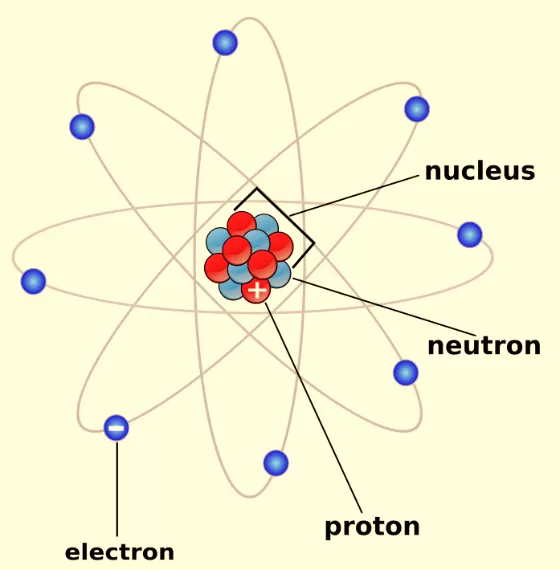
4. Teori Atom Bohr
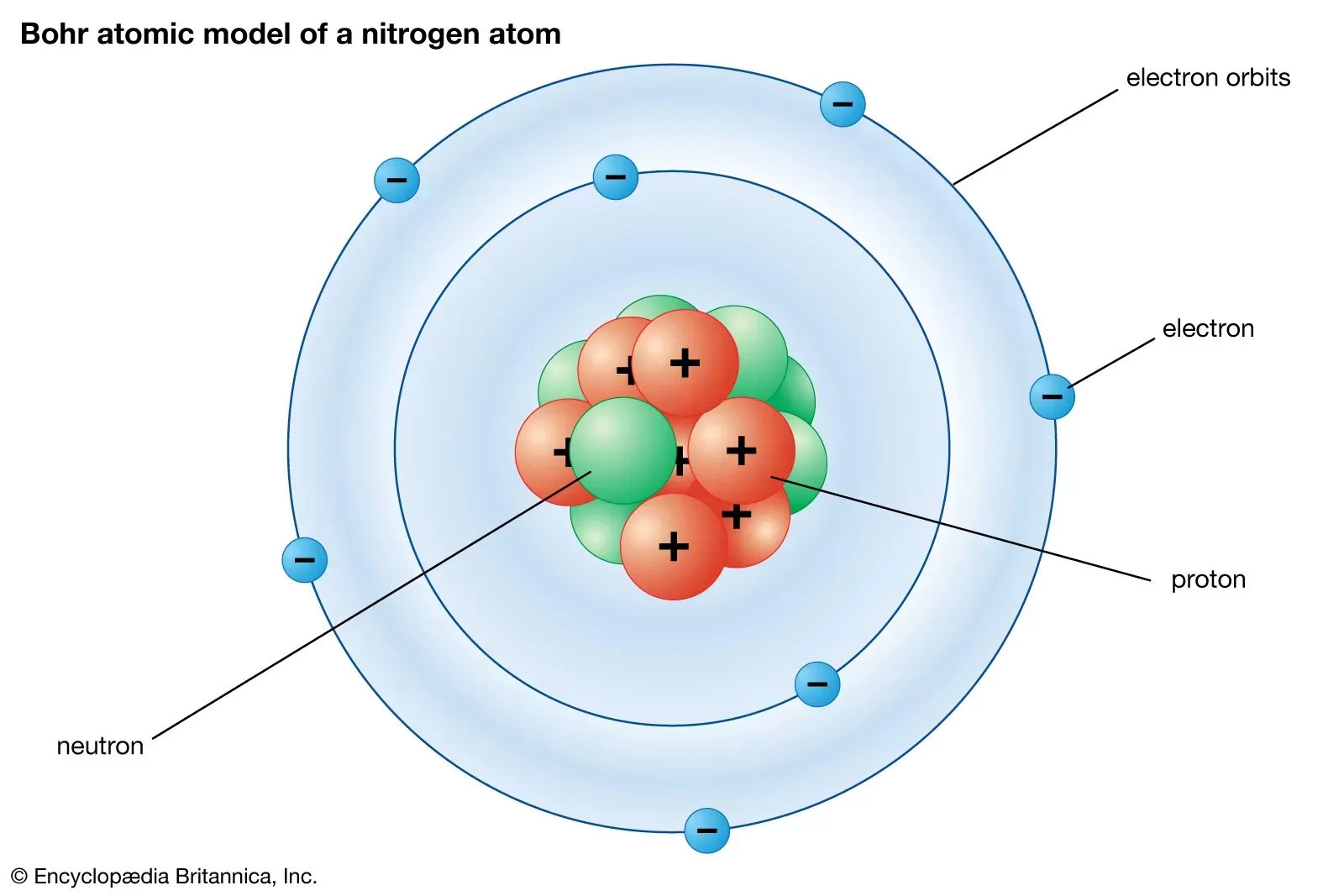
Persamaan:
- Elektron mengorbit dalam orbit-terkuantifikasi di sekitar inti atom.
- Elektron hanya dapat berada dalam tingkat energi tertentu.
Perbedaan:
- Bohr mengembangkan model atom dengan memasukkan konsep mekanika kuantum dan mengajukan bahwa elektron bergerak dalam orbit yang ditentukan oleh tingkat energi yang diskrit.
- Model Bohr berhasil menjelaskan pola spektrum garis atom hidrogen, tetapi tidak sepenuhnya sesuai dengan atom yang lebih kompleks.
5. Teori Atom Mekanika Kuantum
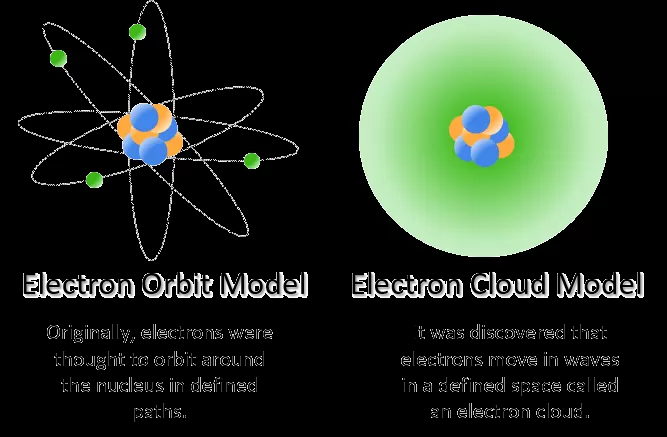
Persamaan:
- Elektron berada dalam keadaan energi diskrit (terkuantifikasi) yang diwakili oleh fungsi gelombang.
- Menggunakan prinsip superposisi untuk menggambarkan distribusi probabilitas elektron di sekitar inti.
Perbedaan:
- Teori atom mekanika kuantum merupakan kerangka kerja matematika yang lebih luas dan akurat daripada model atom sebelumnya.
- Model ini menggambarkan elektron sebagai partikel dan gelombang pada saat yang sama, dengan ketidakpastian posisi yang dinyatakan oleh prinsip ketidakpastian Heisenberg.
- Model mekanika kuantum berhasil menjelaskan sifat atom dan molekul secara lebih rinci dan akurat daripada model sebelumnya.
Seiring dengan perkembangan ilmu pengetahuan, teori atom terus berkembang, dan penelitian lanjutan terus memperdalam pemahaman kita tentang struktur dan sifat atom.