Materi dan energi adalah dua konsep fundamental dalam fisika yang memainkan peran penting dalam pemahaman tentang alam semesta dan berbagai proses yang terjadi di dalamnya. Berikut adalah penjelasan singkat tentang materi dan energi:
1. Materi
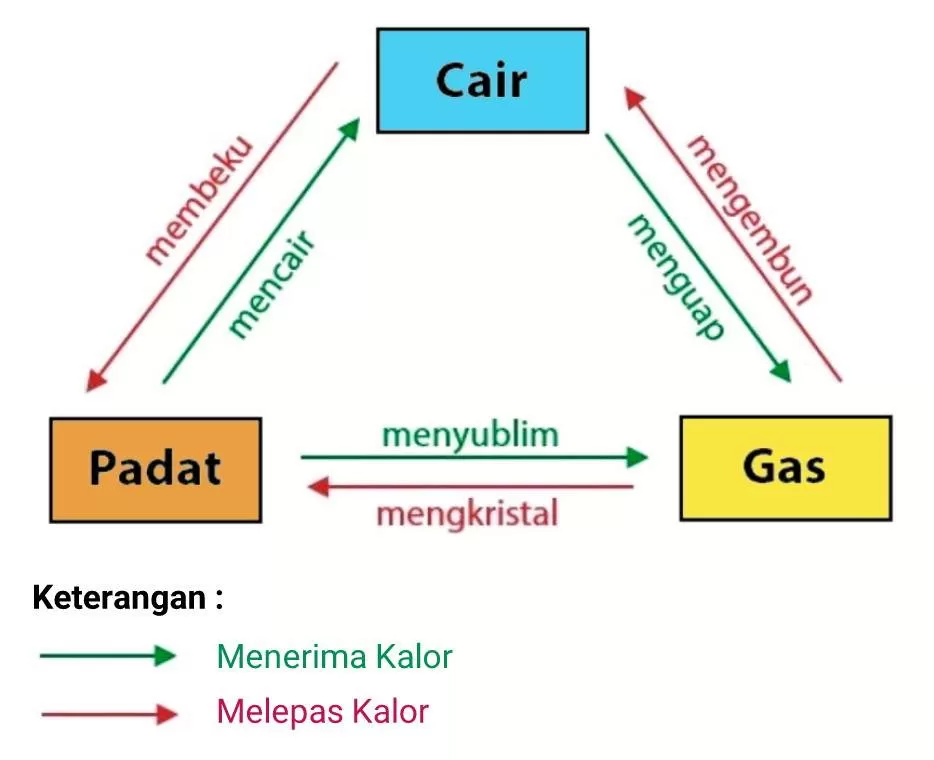
Materi adalah segala sesuatu yang memiliki massa dan volume. Ini termasuk segala macam benda yang kita temui sehari-hari, seperti bumi, batu, air, kayu, logam, dan juga semua makhluk hidup, termasuk manusia. Materi terdiri dari atom, yang pada gilirannya terdiri dari inti atom (proton dan neutron) yang dikelilingi oleh elektron. Ada beberapa bentuk materi, termasuk padat, cair, dan gas. Perubahan dalam materi dapat terjadi melalui proses fisik atau kimia.
a. Sifat Materi
Materi memiliki beberapa sifat dasar yang dapat digunakan untuk mengidentifikasi, mengkarakterisasi, dan memahami berbagai jenis materi. Berikut adalah beberapa sifat materi yang penting:
- Massa. Massa adalah jumlah materi dalam suatu benda dan diukur dalam kilogram atau gram. Massa adalah sifat yang menggambarkan sejauh mana materi memiliki inersia atau tahanan terhadap perubahan gerakan.
- Volume. Volume mengukur seberapa banyak ruang yang ditempati oleh suatu benda. Ini dapat diukur dalam liter, meter kubik, atau unit-volume lainnya. Volume benda padat dapat diukur dengan mengukur panjang, lebar, dan tingginya.
- Densitas. Densitas adalah perbandingan antara massa suatu benda dengan volume yang ditempatinya. Densitas dapat digunakan untuk mengidentifikasi jenis materi, karena benda dengan densitas yang berbeda akan mengapung atau tenggelam dalam cairan dengan cara yang berbeda.
- Tekstur. Tekstur menggambarkan bagaimana suatu benda terasa saat disentuh. Benda dapat memiliki tekstur kasar, halus, licin, atau berpori, misalnya.
- Warna. Warna adalah sifat mata yang menggambarkan bagaimana cahaya dipantulkan atau diserap oleh suatu benda. Warna benda tergantung pada sifat-sifat optiknya.
- Bau. Bau adalah sifat yang berkaitan dengan aroma atau bau suatu benda. Bau dapat digunakan untuk mengidentifikasi zat atau benda tertentu.
- Rasa. Rasa adalah sifat yang terkait dengan bagaimana suatu zat terasa di lidah. Ini adalah sifat yang penting dalam kimia dan pengolahan makanan.
- Konduktivitas. Konduktivitas mengacu pada kemampuan suatu benda untuk menghantarkan panas atau listrik. Material konduktor seperti logam memiliki kemampuan yang tinggi dalam menghantarkan panas dan listrik, sedangkan isolator memiliki konduktivitas yang rendah.
- Titik leleh dan titik didih. Titik leleh adalah suhu pada saat materi berubah dari fase padat ke fase cair, sedangkan titik didih adalah suhu pada saat materi berubah dari fase cair ke fase gas.
- Kelarutan. Kelarutan adalah kemampuan suatu zat untuk larut dalam zat lain. Ini merupakan sifat penting dalam kimia dan digunakan dalam proses seperti pelarutan garam dalam air.
Sifat-sifat ini membantu kita dalam menggolongkan, mengidentifikasi, dan memahami materi yang beragam dalam alam semesta. Beberapa sifat materi dapat diubah melalui proses fisik atau kimia, sementara sifat lainnya bersifat tetap tergantung pada komposisi dan struktur atomik materi tersebut.
b. Perubahan Materi
Perubahan materi adalah perubahan yang terjadi pada sifat-sifat fisik atau kimia suatu benda atau zat. Dalam ilmu kimia, perubahan materi dapat dibagi menjadi dua kategori utama: perubahan fisik dan perubahan kimia. Berikut penjelasan tentang keduanya:
1. Perubahan Fisik:
Perubahan fisik adalah perubahan yang tidak mengubah komposisi kimia suatu benda atau zat. Dalam perubahan fisik, materi tetap sama, hanya sifat fisiknya yang berubah. Contoh perubahan fisik meliputi perubahan bentuk (misalnya, memotong kertas, memadatkan es menjadi air, atau mengubah bentuk benda), perubahan fase (seperti mencairkan es menjadi air atau menguapkan air menjadi uap), dan perubahan ukuran (seperti menghancurkan batu menjadi kerikil). Perubahan fisik dapat diubah kembali menjadi keadaan semula dengan relatif mudah.
2. Perubahan Kimia:
Perubahan kimia adalah perubahan yang mengubah komposisi kimia suatu zat, sehingga menghasilkan zat-zat baru dengan sifat-sifat yang berbeda. Contoh perubahan kimia meliputi pembakaran kayu (menghasilkan abu dan gas karbon dioksida), reaksi antara asam dan logam (menghasilkan gas hidrogen), dan fermentasi gula oleh mikroorganisme (menghasilkan alkohol dan karbon dioksida). Perubahan kimia tidak dapat dengan mudah dikembalikan ke keadaan semula.
Selain perubahan fisik dan kimia, ada beberapa jenis perubahan materi lainnya yang dapat terjadi, seperti:
1. Perubahan Fasa
Perubahan fasa adalah perubahan antara fase padat, cair, dan gas. Contoh termasuk mencairkan es (perubahan dari fase padat menjadi cair) atau menguapkan air (perubahan dari fase cair menjadi gas).
2. Perubahan Nuklir
Perubahan Nuklir adalah perubahan dalam inti atom dan melibatkan perubahan unsur kimia menjadi unsur yang berbeda. Contohnya adalah reaksi fisi nuklir dan fusi nuklir, yang terjadi dalam reaktor nuklir dan bintang.
3. Perubahan Termodinamika
Perubahan termodinamika adalah perubahan yang terkait dengan energi dalam suatu sistem. Contohnya adalah perubahan panas yang terjadi dalam proses pemanasan atau pendinginan.
Pemahaman tentang perubahan materi adalah salah satu konsep dasar dalam kimia dan fisika. Hal ini membantu kita memahami bagaimana benda-benda di alam semesta berinteraksi dan bagaimana reaksi kimia dapat digunakan dalam berbagai aplikasi, seperti produksi bahan kimia, pembangkitan energi, dan pemrosesan makanan.
C. Penggolongan Materi
Materi dapat digolongkan dalam berbagai cara, tergantung pada berbagai sifat dan karakteristik yang digunakan sebagai dasar penggolongan. Berikut adalah beberapa cara umum untuk menggolongkan materi:
1. Menurut Keadaan Fisik
- Materi padat: Materi yang memiliki bentuk dan volume tetap. Atom dan molekul dalam materi padat biasanya sangat terikat satu sama lain.
- Materi cair: Materi yang memiliki volume tetap, tetapi dapat mengalir dan mengambil bentuk wadahnya. Atom dan molekul dalam materi cair kurang terikat daripada dalam materi padat.
- Materi gas: Materi yang tidak memiliki bentuk atau volume tetap. Atom dan molekul dalam materi gas bergerak secara bebas dan memiliki energi kinetik yang tinggi.
2. Menurut Komposisi Kimia
- Campuran: Materi yang terdiri dari dua atau lebih zat yang tercampur bersama tetapi tetap mempertahankan sifat-sifat mereka. Campuran dapat berupa campuran homogen (seperti larutan) atau campuran heterogen (seperti suspensi).
- Zat Murni: Materi yang terdiri dari satu jenis zat kimia yang tidak dapat diuraikan menjadi zat-zat lain melalui metode fisik sederhana. Zat murni dapat berupa unsur atau senyawa.
3. Menurut Konduktivitas Panas dan Listrik
- Konduktor: Materi yang memiliki kemampuan baik untuk menghantarkan panas dan listrik. Contoh konduktor termasuk logam seperti tembaga dan aluminium.
- Isolator: Materi yang memiliki konduktivitas panas dan listrik yang rendah. Contoh isolator termasuk kayu dan kaca.
4. Menurut Kepolaran
- Polar: Materi yang memiliki muatan positif dan negatif yang tidak seimbang dalam molekulnya, sehingga memiliki momen dipol. Contoh molekul polar termasuk air (H2O).
- Nonpolar: Materi yang memiliki muatan positif dan negatif yang seimbang dalam molekulnya, sehingga tidak memiliki momen dipol. Contoh molekul nonpolar termasuk gas helium (He).
5. Menurut Sifat Kimia
- Asam: Materi yang dapat melepaskan ion hidrogen (H+) dalam larutan.
- Basa: Materi yang dapat menerima ion hidrogen (H+) dalam larutan.
- Netral: Materi yang tidak bersifat asam atau basa dan memiliki pH sekitar 7 dalam larutan.
Penggolongan materi ini membantu ilmuwan dan ahli kimia dalam memahami dan bekerja dengan berbagai jenis zat dan bahan kimia. Klasifikasi ini juga memainkan peran penting dalam kimia analitik, pemisahan bahan kimia, dan pengembangan teknologi.
2. Energi

Energi adalah kemampuan untuk melakukan pekerjaan atau menyebabkan perubahan. Ini adalah konsep yang sangat penting dalam fisika karena terlibat dalam hampir semua aspek alam semesta. Energi ada dalam berbagai bentuk, termasuk energi kinetik (energi gerak), energi potensial (energi yang disimpan dalam posisi atau keadaan), energi panas, energi listrik, dan banyak lagi.
Hukum kekekalan energi menyatakan bahwa energi tidak dapat diciptakan atau dihancurkan, tetapi hanya dapat berubah bentuk dari satu bentuk ke bentuk lainnya.
Hubungan antara materi dan energi adalah dasar dari teori relativitas Albert Einstein. Dalam teori ini, E=mc², di mana “E” adalah energi, “m” adalah massa, dan “c” adalah kecepatan cahaya dalam vakum. Ini menunjukkan bahwa materi dan energi sebenarnya dapat berubah menjadi satu sama lain sesuai dengan rumus ini.
Prinsip-prinsip ini membentuk dasar pemahaman kita tentang alam semesta dan digunakan dalam berbagai aplikasi, mulai dari fisika nuklir dan tenaga atom, hingga teknologi energi terbarukan dan pemahaman tentang pergerakan benda di alam semesta.
3. Pemisahan Campuran

Pemisahan campuran adalah proses memisahkan bahan-bahan berbeda dalam suatu campuran agar kita dapat mendapatkan bahan-bahan murni atau komponen-komponen yang terpisah. Berbagai metode dan teknik pemisahan digunakan berdasarkan sifat-sifat fisik dan kimia dari bahan-bahan dalam campuran. Berikut adalah beberapa metode pemisahan campuran yang umum digunakan:
- Saringan atau Penyaringan. Metode ini digunakan untuk memisahkan partikel-padatan dari cairan. Campuran dimasukkan ke dalam saringan, di mana cairan melewati saringan sementara padatan tertahan.
- Destilasi. Destilasi adalah metode pemisahan berdasarkan perbedaan titik didih komponen dalam campuran cair. Campuran dipanaskan, dan uap yang terbentuk kemudian dikondensasikan kembali menjadi cairan. Ini sering digunakan dalam pemisahan cairan campuran, seperti pemurnian air dari garam atau alkohol dari air.
- Ekstraksi. Metode ini digunakan untuk memisahkan zat-zat berdasarkan solubilitasnya dalam pelarut tertentu. Salah satu komponen dalam campuran larut dalam pelarut tertentu, sedangkan yang lain tidak. Setelah ekstraksi, pelarutnya dapat diuapkan untuk meninggalkan komponen yang diinginkan.
- Kromatografi. Ini adalah metode pemisahan yang digunakan dalam kimia untuk memisahkan campuran zat berdasarkan perbedaan kecepatan migrasi zat dalam fase statis dan fase gerak. Jenis kromatografi yang berbeda, seperti kromatografi kertas, kromatografi kolom, atau kromatografi cair-bergas, digunakan tergantung pada keperluan pemisahan.
- Filtrasi. Filtrasi adalah metode pemisahan padatan dari cairan yang mengandung partikel-partikel padatan yang cukup besar untuk ditangkap oleh medium penyaring (seperti kertas saringan atau membran). Cairan yang lolos dari penyaringan disebut filtrat, sedangkan padatan yang tertinggal disebut residu.
- Sublimasi. Sublimasi adalah metode pemisahan yang digunakan untuk memisahkan zat yang dapat berubah langsung dari fase padat menjadi gas tanpa melalui fase cair. Dalam proses sublimasi, zat dipanaskan hingga titik sublimasinya, dan uapnya dikumpulkan dan dikondensasikan kembali menjadi padatan.
- Elektroforesis. Metode ini digunakan untuk memisahkan molekul-molekul berdasarkan muatan listrik dan ukuran mereka. Ini sering digunakan dalam biologi molekuler untuk memisahkan DNA, RNA, atau protein.
- Kristalisasi. Kristalisasi adalah metode pemisahan yang digunakan untuk memisahkan zat dalam larutan yang jenuh dengan zat tersebut. Dengan mendinginkan larutan, zat tersebut akan mengkristal dan dapat dipisahkan dari larutan.
Setiap metode pemisahan memiliki aplikasi khusus tergantung pada jenis campuran yang harus dipisahkan dan sifat-sifat komponennya. Pemahaman tentang metode-metode ini penting dalam kimia dan ilmu-ilmu terkait untuk mengisolasi dan menganalisis berbagai zat dan bahan kimia.
4. Penentuan Kadar Suatu Unsur atau Senyawa

Penentuan kadar suatu unsur atau senyawa adalah proses analitik yang dilakukan untuk mengukur jumlah relatif atau konsentrasi suatu zat dalam campuran atau sampel. Ada beberapa metode yang digunakan untuk menentukan kadar suatu unsur atau senyawa tergantung pada sifat kimia dan fisik zat tersebut. Berikut adalah beberapa metode umum yang digunakan dalam analisis kimia:
1. Spektroskopi
Spektroskopi adalah metode yang menggunakan interaksi cahaya dengan materi untuk mengukur konsentrasi suatu zat. Beberapa jenis spektroskopi yang umum digunakan termasuk:
- Spektroskopi Ultraviolet-Visible (UV-Vis). Digunakan untuk senyawa yang menyerap cahaya ultraviolet atau cahaya tampak.
- Spektroskopi Inframerah (IR). Digunakan untuk mengidentifikasi senyawa berdasarkan gugus fungsionalnya.
- Spektroskopi Fluoresensi. Digunakan untuk analisis senyawa yang menghasilkan fluoresensi saat tereksitasi oleh cahaya.
- Spektroskopi Emisi Atom. Digunakan untuk mengukur konsentrasi unsur-unsur tertentu dalam bentuk atom.
2. Kromatografi
Kromatografi adalah metode pemisahan yang digunakan untuk memisahkan campuran senyawa berdasarkan perbedaan dalam afinitasnya terhadap fase diam (stasioner) dan fase gerak. Beberapa jenis kromatografi meliputi kromatografi cair-tinggi kinerja (HPLC), kromatografi gas (GC), dan kromatografi lapis tipis (TLC).
3. Metode Titrasi
Titrasi adalah metode analisis kimia yang melibatkan penggunaan larutan standar (biasanya berupa larutan titran) untuk menentukan konsentrasi suatu senyawa dalam sampel. Ini sering digunakan untuk menentukan kadar asam, basa, atau garam dalam larutan.
4. Metode Gravimetri
Metode ini digunakan untuk menentukan kadar suatu zat dengan mengukur massa zat tersebut atau massa suatu produk yang dihasilkan dari reaksi kimia tertentu.
5. Analisis Massa Spektrometri
Metode ini digunakan untuk menentukan massa molekul senyawa atau unsur. Massa spektrometer dapat digunakan untuk mengidentifikasi senyawa dan mengukur konsentrasinya dalam sampel.
6. Analisis Elektrokimia
Metode ini melibatkan pengukuran arus listrik atau potensial listrik yang dihasilkan oleh reaksi kimia dalam larutan. Contohnya adalah elektrogravimetri, elektrolisis, atau voltametri.
7. Analisis Titik Titrasi
Metode ini digunakan untuk menentukan kadar asam atau basa dalam sampel dengan menggunakan indikator atau elektroda pH.
Pemilihan metode tergantung pada jenis zat yang akan diukur, kisaran konsentrasi yang diharapkan, dan persyaratan analisis tertentu. Metode analisis yang benar-benar valid dan akurat harus dikalibrasi dengan benar dan mengikuti pedoman yang sesuai. Selain itu, penggunaan peralatan laboratorium yang tepat dan kehati-hatian dalam pengukuran sangat penting untuk mendapatkan hasil yang akurat.