Materi perkembangan teori atom secara ilmiah dimulai oleh John Dalton, kemudian dilanjutkan oleh Thomson, Rutherford, Bohr, dan disempurnakan oleh teori atom Mekanika Kuantum.
1. Teori Atom Dalton

Materi perkembangan teori atom dimulai ketika John Dalton mengungkapkan bahwa:
- Atom merupakan bagian terkecil yang materi yang sudah tidak dapat dibagi lagi.
- Atom digambarkan sebagai bola pejal yang sangat kecil.
- Suatu unsur memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda.
- Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana.
- Atom tidak dapat diciptakan atau dimusnahkan.
Kelebihan Teori Atom Dalton
- Dapat menjelaskan hukum kekekalan massa
- Dapat menjelaskan hukum perbanding tetap
Kelemahan Teori Atom Dalton
- Asumsinya bahwa semua atom dari suatu unsur memiliki massa dan sifat yang sama terbukti tidak benar.
- Asumsinya bahwa selama reaksi kimia, atom tidak bisa diciptakan dan dimusnahkan, teori ini kurang tepat. Karena sekarang faktanya telah ada sedikit perubahan energi listrik pada bagian luar atom sehingga atom dapat menggandakan ikatan satu dengan lainnya.
- Teori atom Dalton tidak dapat menerangkan suatu larutan dapat menghantarkan arus listrik.
2. Teori Atom Thomson
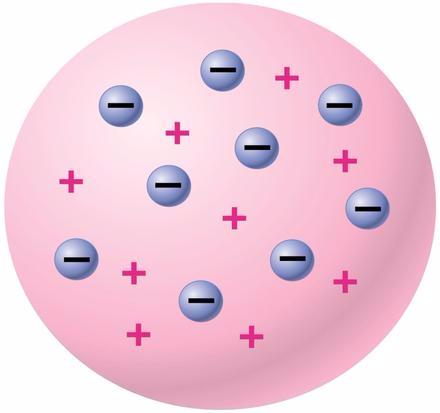
Thomson mengungkapkan bahwa:
- Atom adalah materi yang bermuatan positif dan didalamnya tersebar elektron (muatan negatif) bagaikan roti kismis
- Sinar katoda merupakan partikel penyusun atom yang bermuatan negatif yang lebih dikenal dengan sebutan elektron.
Kelebihan Teori Atom Thomson
- Membuktikan adanya partikel lain yang bermuatan negatif dalam atom. Hal tersebut membuktikan bahwa atom bukan merupakan bagian terkecil dari suatu unsur.
Kelemahan Teori Atom Thomson
- Tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
3. Teori Atom Rutherford
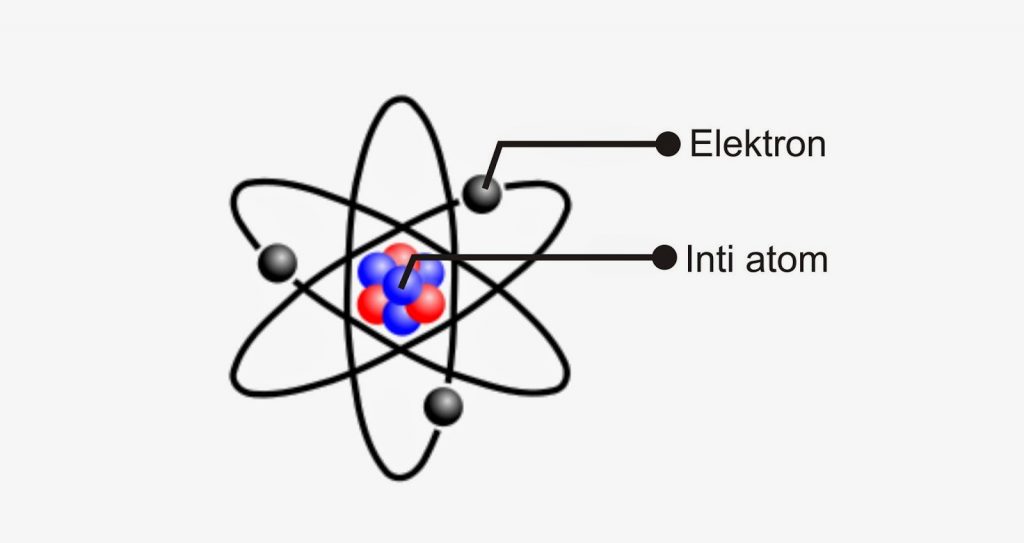
Rutherford mengungkapkan bahwa:
- Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang jumlahnya sama dengan muatan inti.
- Di dalam inti atom terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak-menolak.
- Muatan inti berbeda-beda pada setiap jenis atom, besarnya sekitar setengah dari nilai bobot atom suatu unsur.
Kelebihan Teori Atom Rutherford
- Atom tersusun dari inti atom dan elektron yang mengelilingi inti
- Rutherford telah memperkenalkan lintasan elektron yang kini kita kenal dengan kulit atom.
Kelemahan Teori Atom Rutherford
- Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom
4. Teori Atom Niels Bohr

Niels Bohr mengemukakan bahwa:
- Atom terdiri atas inti atom yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam suatu lintasan.
- Elektron dapat berpindah dari satu lintasan ke lintasan yang lain dengan menyerap atau memancarkan energi sehingga energi elektron atom itu tidak akan berkurang. Jika berpindah dari lintasan rendah ke lintasan yang lebih tinggi maka elektron akan menyerap energi. Sebaliknya, jika berpindah dari lintasan tinggi ke rendah maka akan memancarkan energi.
Kelebihan Teori Atom Niels Bohr
- Dapat menjelaskan bahwa atom terdiri dari beberapa kulit untuk tempat perpindahan elektron.
Kelemahan Teori Atom Niels Bohr
- Tidak dapat menjelaskan spektrum warna dari atom berelektron banyak
5. Teori Atom Mekanika Kuantum
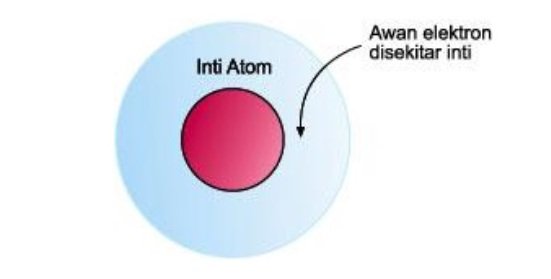
Teori atom mekanika kuantum menjelaskan bahwa di dalam atom, elektron beredar pada orbital-orbital, yaitu daerah disekitar inti atom dengan kebolehjadian menemukan elektron.
Teori atom mekanika kuantum memiliki persamaan dengan Teori Atom Niels Bohr di mana tingkatan energi dalam bentuk lintasan elektron. Akan tetapi, posisi elektron tidak pasti. Hal yang dapat ditentukan mengenai keberadaan elektron dalam atom adalah daerah dengan peluang terbesar untuk menemukan elektron yang dinamakan dengan sebutan Orbital.