Tidak hanya manusia, hewan, dan tumbuhan yang memiliki sifat. Periodik unsur juga memiliki sifat sehingga bisa menjadi ciri khas dari periodik unsur. Sifat-sifat periodik unsur terjadi karena sifat-sifat unsur yang berulang secara periodik. Sifat-sifat itu terdiri dari jari-jari atom, energi ionisasi, afinitas elektron, dan kelektronegatifan.
1.Jari – jari Atom
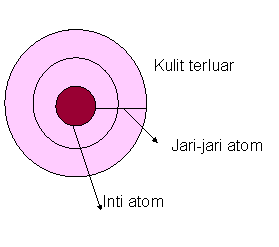
Jari – jari atom adalah separuh jarak antara dua inti atom yang saling berdekatan atau lebih mudahnya jarak antara inti atom dengan elektron valensi. Inti atom yang saling berdekatan berbeda dengan molekul diatomik. Jari-jari atom molekul diatomik memiliki arti sendiri, yaitu setengah jarak antar inti atom dalam suatu molekul.
Dalam sistem periodik diketahui bahwa dalam satu golongan, jari-jari atom semakin ke atas jari-jarinya semakin pendek. Karena dalam satu golongan semakin ke atas, jumlah kulit atom semakin sedikit sehingga jarak antar inti atom dengan elektron valensi semakin pedek.
Dalam satu periode, jari-jari atom semakin ke kanan semakin pendek. Karena dalam satu periode memiliki jumlah kulit yang sama, namun memiliki jumlah elektron valensi yang berbeda. Semakin ke kanan, jumlah elektron valensinya semakin banyak dan menyebabkan gaya tarik menarik antara inti atom dengan elektron valensi semakin kuat. Sehingga jari-jari atom semakin pendek.
2. Energi Ionisasi

Energi ionisasi adalah energi minimum yang diperlukan untuk melepaskan satu elektron dari suatu atom dalam keadaan dasar (berada dalam wujud gas). Energi ionisasi sangat dipengaruhi oleh jari-jari atom. Jika jari-jarinya pendek maka energi ionisasinya besar, dan sebaliknya jika jari-jarinya panjang, maka energi ionisasinya kecil.

Lebih jelasnya begini. Jika jari-jari atom semakin pendek berarti gaya tarik antar inti dengan elektron valensi semakin kuat, dan sebaliknya jika jari-jari atom semakin panjang berarti gaya tarik antar inti dengan elektron valensi semakin lemah. Oleh sebab itu, dalam satu golongan, semakin ke atas energi ionisasinya semakin besar. Sedangkan dalam satu periode semakin ke kanan energi ionisasinya semakin besar.
3. Afinitas Elektron

Setiap atom memiliki sifat dapat melepas dan menerima elektron. Ketika melepaskan elektron, atom-atom dalam periodik unsur tidak memerlukan energi. Namun sebaliknya, ketika mereka menerima elektron mereka memerlukan energi. Energi inilah yang disebut sebagai afinitas elektron. Lebih singkatnya, afinitas elektron adalah energi yang dibebaskan suatu atom untuk menerima satu atau lebih elektron.

Dalam sistem periodik diketahui bahwa dalam satu golongan semakin ke atas atom-atom cenderung mudah melepaskan elektron. Begitu juga dalam satu periode, semakin ke kanan maka atom-atom cenderung lebih mudah melepaskan elektron. Oleh sebab itu, avinitas elektron dalam satu golongan, semakin ke atas semakin negatif. Begitu juga dalam satu periode, semakin ke kanan afinitas elektron semakin negatif.
Sebaliknya, dalam satu periode semakin ke kiri harga afinitas elektron semakin postif. Begitu juga dalam satu golongan semakin ke bawah afinitasnya juga semakin positif. Sehingga, suatu atom akan semakin sulit menerima elektron dan cenderung melepaskan elektron.
Baca juga: Menentukan letak unsur dalam tabel periodik
4. Keelektronegatifan
Keelektronegatifan diartikan sebagai kemampuan suatu atom/unsur untuk menarik elektron valensi dari suatu molekul/ikatan. Kelektronegatifan dilambangkan dengan Skala Pauling. Sekala pauling memiliki nilai rendah 0.7 dan nilai tertinggi 4.0.

Dalam sistem periodik, kelektronegatifan semakin meningkan dari bawah ke atas dan dari kiri ke kanan. Maksudnya, dalam satu golongan semakin ke atas maka harga keelektronegatifan semakin besar dan dalam satu periode semakin ke kanan maka harga keelektronegatifan semakin besar.
