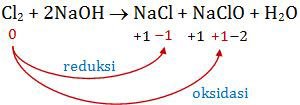Berikut adalah soal-soal Ujian Nasional (UN) kimia tentang materi redoks yang kami ambil dari soal-soal UN kimia 5 tahun terakhir dan telah kami rangkum ke dalam soal UN Redoks dan Pembahasan. Selain tentang redoks, juga tentang elektrokimia. Silakan bisa kamu pelajari soal un redoks dan pembahasannya ini secara mandiri. Jika ada pertanyaan mengenai soal UN redoks dan elektrokimia bisa ditanyakan melalui kolom komentar.
Soal UN Redoks dan Elektrokimia Tahun 2013 dan Pembahasannya
Diketahui beberapa persamaan reaksi berikut:
- C2O42- → 2CO2 + 2e
- Al3+ + 3e → Al
- Pb2+ + 2e → Pb
- Ca → Ca2+ + 2e
Persamaan reaksi reduksi ditunjukkan pada nomor ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan:
Karena reaksi-reaksi di atas merupakan reaksi redoks dalam keadaan setengah reaksi. Maka yang harus kamu lakukan cukup memperhatikan letak elektronnya saja. Jika elektron di ruas kiri berarti reaksi kimia tersebut merupakan reaksi reduksi. Sedangkan jika elektron di ruas kanan berarti reaksi kimia tersebut merupakan reaksi oksidasi. Jadi, persamaan reaksi reduksi ditunjukkan pada nomor 2 dan 3. Jawaban C.
Soal UN Redoks dan Elektrokimia Tahun 2014 dan Pembahasannya
Perhatikan potensial elektroda standar berikut!
- Cr3+ (aq) + 3e → Cr (s) E0 = -0,71 volt
- Ag+ (aq) + e → Ag (s) E0 = +0,80 volt
- Al3+ (aq) + 3e → Al (s) E0 = -1,66 volt
- Zn2+ (aq) + 2e → Zn (s) E0 = -0,74 volt
Notasi sel yang dapat berlangsung spontan adalah ….
A. Ag|Ag+ || Cr3+ | Cr
B. Ag|Ag+ || Zn2+ | Zn
C. Cr|Cr3+ || Al3+ | Al
D. Zn|Zn2+ || Al3+ | Al
E. Zn|Zn2+ ||Ag+ | Ag
Pembahasan:
Soal ini merupakan soal redoks dan elektrokimia yang sangat mudah, untuk menyelesaikannya kamu hanya perlu mengurutkan atom-atom berdasarkan potensial elektrodanya dari kecil ke besar. Sehingga diperoleh urutan sebagai berikut:
Al < Zn < Cr < Ag
Ingat-ingat! Semakin kecil potensial elektroda suatu atom maka akan semakin mudah mengalami oksidasi dan semakin besar potensial elektroda suatu atom maka akan semakin mudah mengalami reduksi. Berdasarkan opsi di atas, jawaban yang benar adalah E. Karena potensial reduksi Zn lebih kecil daripada potensial reduksi Ag.
Soal UN Redoks dan Elektrokimia Tahun 2015 dan Pembahasannya
Reaksi klorin dengan basa membentuk klorida dan hipoklorit menurut reaksi:
Cl2(g) + 2NaOH (aq) → NaCl (aq) + NaClO (aq) + H2O (l)
Zat yang mengalami reaksi autoredoks beserta perubahan bilangan oksidasinya adalah .…
A. Cl2 dari -1 menjadi +1 dan 0
B. Cl2 dari +1 menjadi -1 dan 0
C. NaOH dari 0 menjadi -1 dan +1
D. NaOH dari -1 menjadi +1 dan 0
E. Cl2 dari 0 menjadi -1 dan +1
Pembahasan:
Mari kita lihat reaksi autoredoksnya:
Jadi, zat yang mengalami reaksi autoredoks beserta perubahan bilangan oksidasinya adalah Cl2 dari 0 menjadi -1 dan +1. Jawaban E.
Soal UN Redoks dan Elektrokimia Tahun 2016 dan Pembahasannya
Diketahui E0
- Zn2+ | Zn = -0,76 volt
- Fe2+ | Fe = -0,44 volt
- Pb2+ | Pb = -0,13 volt
- Cu2+ | Cu = +0,34 volt
- Ag2+ | Ag = +0,80 volt
Diagram sel yang berlangsung spontan adalah ….
A. Cu2+ | Cu || Zn2+ | Zn
B. Ag2+ | Ag || Fe2+ | Fe
C. Ag2+ | Ag || Zn2+ | Zn
D. Pb2+ | Pb || Cu2+ | Cu
E. Pb2+ | Pb || Zn2+ | Zn
Pembahasan:
Pembahasan soal ini sama seperti soal UN redoks dan elektrokimia tahun 2014 di atas. Jawaban D.
Soal UN Redoks dan Elektrokimia Tahun 2017 dan Pembahasannya
Perhatikan persamaan reaksi redoks berikut!
Sn (s) + 4HNO3 (aq) → SnO2(s) + 4NO2(g) + 2H2O (l)
Bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah ….
A. +1, Sn
B. +1, SnO2
C. +4, NO2
D. +5, NO2
E. +5, HNO3
Pembahasan:
Jadi, bilangan oksidasi dari zat oksidator dan hasil reduksinya berturut-turut adalah +5, NO2. Jawaban D.
Pelajari Lebih Lanjut:
- 10 Soal Redoks Pilihan Ganda dan Pembahasannya
- 12 Contoh Soal Hukum Dasar Kimia dan Jawabannya
- 10 Contoh Soal Persamaan Reaksi Kimia dan Jawabannya
- Contoh Soal Reaksi Oksidasi, Reduksi, dan Redoks
- Soal Try Out Kimia Sma dan Pembahasannya (Nomor 1 – 10)
- Soal Try Out Kimia Sma dan Pembahasannya (Nomor 11 – 20)