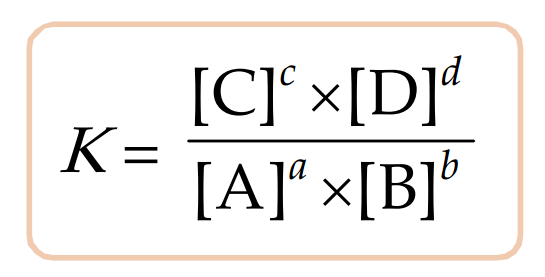Syarat reaksi kesetimbangan dinamis atau syarat kesetimbangan kimia menyangkut reaksi yang berlangsung dalam kedua arah, yaitu reaksi maju dan reaksi mundur, pada kondisi kesetimbangan. Pada titik kesetimbangan, laju reaksi maju dan laju reaksi mundur menjadi sama sehingga tidak ada perubahan konsentrasi reaktan dan produk dalam sistem.
Untuk suatu reaksi kesetimbangan dinamis, ada dua syarat yang harus dipenuhi:
1. Kesetimbangan Konstan (K)
Konstanta kesetimbangan (K) adalah suatu nilai tetap yang menyatakan konsentrasi produk dan reaktan pada kesetimbangan. Untuk reaksi kesetimbangan berikut:
aA + bB ⇌ cC + dD
K ditentukan oleh persamaan berikut:
Di mana [A], [B], [C], dan [D] adalah konsentrasi masing-masing zat dalam kesetimbangan. Jika nilai K besar, maka pada kesetimbangan, produk cenderung lebih banyak. Sebaliknya, jika nilai K kecil, maka reaktan cenderung lebih banyak pada kesetimbangan.
2. Reaksi Reversible
Reaksi harus bersifat reversibel, artinya reaksi dapat berlangsung dalam kedua arah, maju dan mundur. Dalam kasus reaksi irreversible (seperti dekomposisi senyawa menjadi produk yang tidak dapat terurai kembali), kesetimbangan dinamis tidak dapat tercapai.
Jika kedua syarat ini terpenuhi dan sistem berada dalam kondisi tertutup atau setengah tertutup (tanpa adanya perubahan tekanan, suhu, atau konsentrasi), maka kesetimbangan dinamis dapat tercapai. Saat mencapai kesetimbangan, reaksi masih berlangsung dalam kedua arah, tetapi tidak ada perubahan netto dalam konsentrasi produk dan reaktan dalam sistem tersebut.