Soal No. 1
Molekul senyawa berikut yang bukan merupakan senyawa kovalen polar adalah ….
A. HCl
B. H2O
C. NH3
D. CHCl
E. Cl2
Jawaban: E
Pembahasan:
Molekul Cl2 terdiri dari 2 atom yang sama yaitu Cl sehingga selisih keelektronegatifannya adalah 0. Hal tersebut tidak mengakibatkan terjadinya pemisahan kutub oleh karena itu Cl2 adalah senyawa nonpolar.
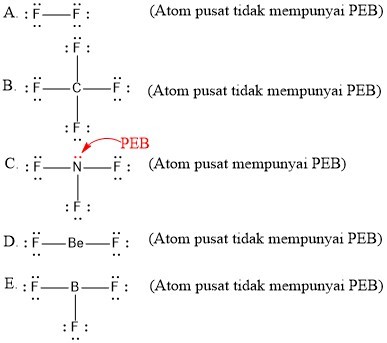
Soal No. 2
Di antara molekul-molekul berikut yang paling polar adalah ….
A. F2
B. CF4
C. NF3
D. BeF2
E. BF3
Jawaban: C
Pembahasan:
Salah satu cara menentukan senyawa polar dan non-polar adalah dengan cara melihat pasangan elektron bebas (PEB) pada atom pusat.
- Apabila atom pusat memiliki PEB maka senyawa tersebut dapat dipastikan merupakan senyawa polar.
- Apabila atom pusat tidak memiliki PEB maka senyawa tersebut tergolong senyawa non polar.
Soal No. 3
Diketahui skala keelektronegatifan unsur H = 2,1; O = 3,5; C = 2,5; N = 3,0; dan Cl = 3,0. Molekul berikut yang paling polar adalah ….
A. NH3
B. H2O
C. CH4
D. HCl
E. H2
Jawaban: B
Pembahasan:
Molekul polar ditandai dengan adanya perbedaan keelektronegatifan, semakin besar perbedaan keelektronegatifannya maka semakin polar juga molekul tersebut. Sedangkan molekul non polar tidak mempunyai perbedaan keelektronegatifan.
A. NH3 → (N = 3) (H = 2,1) → 3 – 2,1 = 0,9
B. H2O → (H = 2,1) (O = 3,5) → 3,5 – 2,1 = 1,4
C. CH4 → (C = 2,5) (H = 2,1) → 2,5 – 2,1 = 0,4
D. HCl → (H = 2,1) (Cl = 3) → 3 – 2,1 = 0,9
E. H2 → (H = 2,1) (H = 2,1) → 2,1 – 2,1 = 0
Jadi, molekul yang paling polar adalah H2O karena memiliki perbedaan keelektronegatifan yang paling besar.
Soal No. 4
Perhatikan tabel berikut.
| Unsur | H | P | C | Cl | O |
| Keelektronegatifan | 2,1 | 2,1 | 2,5 | 3,0 | 3,5 |
Berdasarkan data tersebut, senyawa yang paling polar adalah ….
A. CO2
B. ClO
C. CH4
D. HCl
E. PH3
Jawaban: A
Pembahasan:
A. CO2 → (C = 2,5) (O = 3,5) → 3,5 – 2,5 = 1
B. ClO → (Cl = 3,0) (O = 3,5) → 3,5 – 3,0 = 0,5
C. CH4 → (C – 2,5) (H = 2,1) → 2,5 – 2,1 = 0,4
D. HCl → (H = 2,1) (Cl = 3,0) → 3,0 – 2,1 = 0,9
E. PH3 → (P = 2,1) (H = 2,1) → 2,1 – 2,1 = 0
Soal No. 5
Di antara molekul-molekul di bawah ini yang merupakan molekul non-polar adalah ….
A. CHCl3
B. HCl
C. BCl3
D. CH3Cl
E. NH3
Jawaban: C
Pembahasan:
Karena molekul BCl3 tidak mempunyai PEB
Soal No. 6
Molekul yang ikatan antar-atomnya merupakan ikatan kovalen polar tetapi molekulnya bersifat non-polar adalah ….
A. CCl4
B. H2O
C. CHCl3
D. NH3
E. Cl2
Jawaban: A
Pembahasan:
Ikatan antara atom C dan Cl merupakan ikatan kovalen polar karena atom C dan Cl mempunyai perbedaan keelektronegatifan sebesar 0,5. Namun, molekul CCl4 bersifat non polar karena tidak memiliki pasangan elektron bebas (PEB)
Soal No. 7
Pasangan senyawa berikut yang molekulnya polar dan non-polar berturut-turut adalah …
A. CH4 dan CCl4
B. NH3 dan CO2
C. CCl4 dan CO2
D. H2O dan NH3
E. CO2 dan H2O
Jawaban: B
Pembahasan:
CH4 → Non polar
CCl4 → Non polar
CO2 → Non polar
NH3 → Polar
H2O → Polar
Soal No. 8
Kelompok senyawa berikut yang semuanya bersifat non-polar adalah …
A. CO2; CH4; dan CCl4
B. H2O; CO2; dan HCl
C. NH3; HF; dan CO
D. H2O; SO2; dan CaO
E. HCl; HF; dan H2O
Jawaban: A
Pembahasan:
CO2 → Non polar
CH4 → Non polar
CCl4 → Non polar
H2O → Polar
HCl → Polar
NH3 → Polar
HF → Polar
CO → Polar
SO2 → Polar
CaO → Non polar
Soal No. 9
Di antara pasangan senyawa berikut yang keduanya merupakan senyawa kovalen non-polar adalah ….
A. H2O dan CO2
B. CH4 dan PCl3
C. CHCl3 dan H2O
D. NaCl dan HCl
E. CO2 dan CH4
Jawaban: E
Pembahasan:
H2O → Polar
CO2 → Non polar
CH4 → Non polar
PCl3 → Polar
CHCl3 → Polar
NaCl → Polar
HCl → Polar
Soal No. 10
Perhatikan data keelektronegatifan beberapa unsur berikut.
| Unsur | Keelektronegatifan |
| P | 2,1 |
| Q | 2,5 |
| R | 3,0 |
| S | 3,5 |
| T | 4,0 |
Senyawa yang bersifat paling polar adalah …
A. QS
B. RS
C. PR
D. PT
E. PQ
Jawaban: D
Pembahasan:
A. QS → 3,5 – 2,5 = 1
B. RS →3,5 – 3,0 = 0,5
C. PR → 3,5 – 2,1 = 1,4
D. PT → 4,0 – 2,1 = 1,9
E. PQ → 2,5 – 2,1 = 0,4