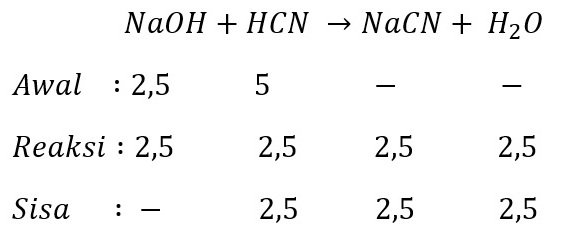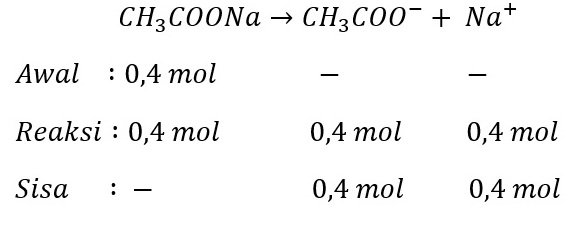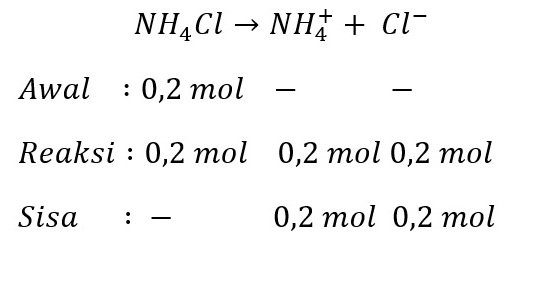Contoh Soal Larutan Penyangga Nomor 6-10
Soal No. 6
Dicampurkan dua larutan yaitu 200 mL larutan HNO2 0,15 M dengan 150 mL larutan KOH 0,1 M. Berapa pH campuran larutan tersebut… (Ka = 10-5)
Pembahasan
Diketahui:
V HNO2 = 200 mL; M HNO2 = 0,15 M
V KOH = 150 mL; M KOH = 0,1 M
Ka = 10-5
Ditanya: pH….?
Jawab:
n HNO2 = V x M = 200 mL x 0,15 M = 30 mmol
n KOH = V x M = 150 mL x 0,1 M = 15 mmol
[H+] = Ka (A/G)
[H+] = 10-5 (15/15)
[H+] = 10-5
pH = -log[H+]
pH = -log 10-5
pH = 5
Soal No. 7
Terdapat beberapa larutan berikut:
- 25 mL NaOH 0,1 M;
- 25 mL HCN 0,2 M;
- 25 mL CH3COOH 0,1 M;
- 25 mL NH4OH 0,2 M; dan
- 25 mL HCl 0,2 M.
Pasangan senyawa yang dapat membentuk larutan penyangga adalah…
Pembahasan
Hal yang paling penting jika terdapat soal semacam ini, kita perhatikan jumlah molnya. Sekarang coba kita lihat jumlah mol keseluruhan senyawa di atas.
- n NaOH = V x M = 25 mL x 0,1 M = 2,5 mmol
- n HCN = V x M = 25 mL x 0,2 M = 5 mmol
- n CH3COOH = V x M = 25 mL x 0,1 M = 2,5 mmol
- n NH4OH = V x M = 25 mL x 0,2 M = 5 mmol
- n HCl = V x M = 25 mL x 0,2 M = 5 mmol
Ingat juga, larutan penyangga terbentuk dari hasil reaksi asam kuat + basa lemah dan basa kuat + asam lemah yang diakhir reaksi tersisa basa lemah atau asam lemah.
Kita lihat pasangan nomor 1 dan 2
Dari reaksi dapat kita lihat terdapat sisi asam lemah sebesar 2,5 mmol. Jadi pasangan 1 dan 2 termasuk larutan penyangga.
Soal No. 8
Diberikan campuran dari beberapa larutan sebagai berikut:
- 200 mL CH3COOH 0,1 M dan 200 mL NaOH 0,1 M
- 200 mL CH3COOH 0,2 M dan 200 mL NaOH 0,1 M
- 200 mL NH4OH 0,1 M dan 200 mL HCl 0,1 M
- 200 mL NH4OH 0,1 M dan 200 mL HCl 0,05 M
Campuran yang membentuk larutan penyangga adalah…
Pembahasan:
 Kita bisa lihat bahwa yang memiliki sisa adalah reaksi nomor 2 dan 4. Jadi, yang membentuk larutan penyangga adalah nomor 2 dan 4.
Kita bisa lihat bahwa yang memiliki sisa adalah reaksi nomor 2 dan 4. Jadi, yang membentuk larutan penyangga adalah nomor 2 dan 4.
Soal No. 9
Suatu larutan penyangga mengandung CH3COONa 0,4 mol dan CH3COOH 0,25 mol. Jika Ka = 1,8 x 10-5, maka tentukan pH larutan penyangga.
Pembahasan:
Diketahui:
n CH3COONa = 0,4 mol
n CH3COOH = 0,25 mol
Ka = 1,8 x 10-5
Ditanya: pH larutan penyangga …?
Jawab:
Kita cari mol basa konjugasinya terlebih dahulu
Kemudian, kita hitung pHnya:
pH = pKa – log ([CH3COOH]/[CH3COO–])
pH = -log (1,8 x 10-5) – log (0,25 mol/0,4 mol)
pH = -(log 1,8 + log 10-5) – log 0,625
pH = 4,74 – (-0,20)
pH = 4,94
Jadi, pH larutan penyangga sebesar 4,94.
Soal No. 10
Hitung pH suatu larutan penyangga yang mengandung NH4Cl 0,2 mol dan NH3 0,15 mol jika pKb NH3 = 4,73.
Pembahasan:
Kita cari terlebih dahulu jumlah mol asam konjugasinya
pOH larutan penyangga dapat kita hitung dengan rumus
pOH = pKb – log [NH3]/[NH4+]
pOH = 4,74 – log 0,15/0,2
pOH = 4,74 – (-0,12) = 4,86
pH = 14 – pOH
pH =14 – 4,86 = 9,14
Jadi, pH larutan penyangga tersebut sebesar 9,14.
Pelajari juga materi yang bersangkutan dengan contoh soal larutan penyangga di atas:
- Pengertian dan Macam-Macam Larutan Penyangga/Buffer
- 6 Sifat Larutan Penyangga/Buffer
- Rumus Tetapan Hidrolisis (Kh)
- 10 Soal Hidrolisis Garam dan Pembahasannya
- Titrasi Asam Basa dan Kurva Titrasi