Kestabilan suatu atom menurut G.N. Lewis dan Kossel berikaitan dengan konfigurasi elektron dari atom itu. Atom-atom yang sukar bergabung dengan atom lain disebut sebagai atom stabil. Dalam sistem periodik unsur, gas mulia merupakan golongan atom-atom stabil.
Atom-atom gas mulia memiliki konfigurasi elektron penuh sehingga merupakan atom stabil. Konfigurasi elektron atom stabil adalah sebagai berikut.
2He : 2
10Ne : 2 8
18Ar : 2 8 8
36Kr : 2 8 18 8
54Xe : 2 8 18 18 8
Konfigurasi elektron atom-atom akan stabil bila jumlah elektron terluarnya 2 (duplet) seperti pada Helium (He) atau 8 (oktet) seperti pada atom-atom gas mulia yang lain. Untuk mencapai kestabilan atom seperti gas mulia, dapat dilakukan dengan cara membentuk ion atau penggunaan pasangan elektron bersama.
1. Membentuk Ion
Suatu atom dapat membentuk ion dengan cara melepas elektron yang dimiliki atau mengikat elektron dari atom lain, yang dikenal sebagai peristiwa ionisasi. Pembentukan ion dari suatu atom terjadi karena adanya kecenderungan atom untuk memiliki energi potensial lebih rendah.
Atom-atom yang memiliki energi ionisasi rendah cenderung untuk melepaskan elektron dan membentuk ion positif (+) atau anion, sedangkan atom-atom yang memiliki afinitas elektron tinggi, cenderung untuk mengikat elektron dan membentuk ion negatif (-) atau kation.
Contoh Pembentukan Ion Positif (+) atau Anion:
Atom 11Na : 2 8 1 (konfigurasi elektron tidak stabil)
Agar stabil, atom Na melepas sebuah elektronnya sehingga konfigurasi elektronnya sama dengan atom Ne (konfigurasi elektron 10Ne : 2 8)
11Na → Na+ + e–
Proses pembentukan ion positif (ionisasi) tersebut mudah terjadi karena atom Na mempunyai energi ionisasi yang rendah.
Contoh Pembentukan Ion Negatif (-) atau Kation:
Atom 17Cl : 2 8 7 (konfigurasi elektron tidak stabil)
Agar stabil, atom Cl perlu mengikat sebuah elektron sehingga konfigurasi elektronnya sama dengan atom Ar (konfigurasi elektron 18Ar : 2 8 8)
17Cl + e– → Cl–
Proses pengikatan elektron tersebut mudah terjadi dikarenakan afinitas elektron atom klorin besar.
2. Penggunaan Pasangan Elektron Bersama
Atom-atom yang mempunyai energi ionisasi tinggi akan sukar melepas elektronnya, sehingga dalam mencapai kestabilan akan sukar membentuk ion positif. Demikian pula dengan atom-atom yang mempunyai afinitas elektron rendah untuk mencapai kestabilan sukar membentuk ion negatif.
Atom-atom yang sukar membentuk ion akan cenderung membentuk pasangan elektron yang digunakan secara bersama-sama. Pasangan elektron yang dibentuk oleh atom-atom yang berikatan dapat berasal dari kedua atom yang bergabung atau dari salah satu atom.
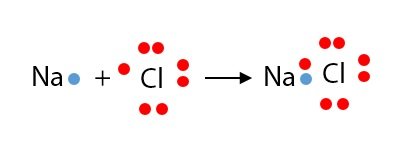
Contohnya: Ikatan ion pada NaCl
Atom Na memberikan 1 elektronnya pada atom Cl, sehingga Na bermuatan positif dan Cl bermuatan negatif. Kemudian keduanya saling berikatan membentuk senyawa NaCl dan memenuhi kaidah oktet.