Bentuk molekul adalah gambaran tentang susunan atom-atom dalam molekul berdasarkan susunan ruang pasangan elektron dalam atom atau molekul, baik pasangan elektron bebas (PEB) maupun pasangan elektron ikat (PEI).
Bentuk molekul suatu senyawa dapat ditentukan dengan teori tolakan pasangan elektron (Valence Shell Electron Pair Repulsion = VSEPR) dan teori hibridisasi
1. Cara Menentukan Bentuk Molekul dengan Teori VSEPR
Dalam teori VSEPR, bentuk molekul diramalkan dari susunan pasangan elektron di sekitar atom pusat berdasarkan tolakan pasangan-pasangan elektron tersebut. Oleh sebab itu, teori VSEPR disebut juga sebagai teori jumlah pasangan elektron.
Langkah-langkah untuk menentukan bentuk molekul dengan teori VSEPR. Misalnya, kita akan menentukan bentuk molekul H2O (8Odan 1H).
1. Tentukan jumlah elektron valensi setiap atom.
8O : 2, 6 (elektron valensi O = 6)
1H : 1 (elektron valensi H = 1)
2. Gambarkan struktur Lewisnya
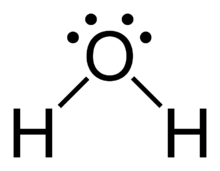
3. Tentukan jumlah pasangan elektron bebas (PEB) dan pasangan elektron ikat (PEI) pada atom pusat (atom pusat adalah atom yang dikelilingi oleh dua atau lebih atom lain).
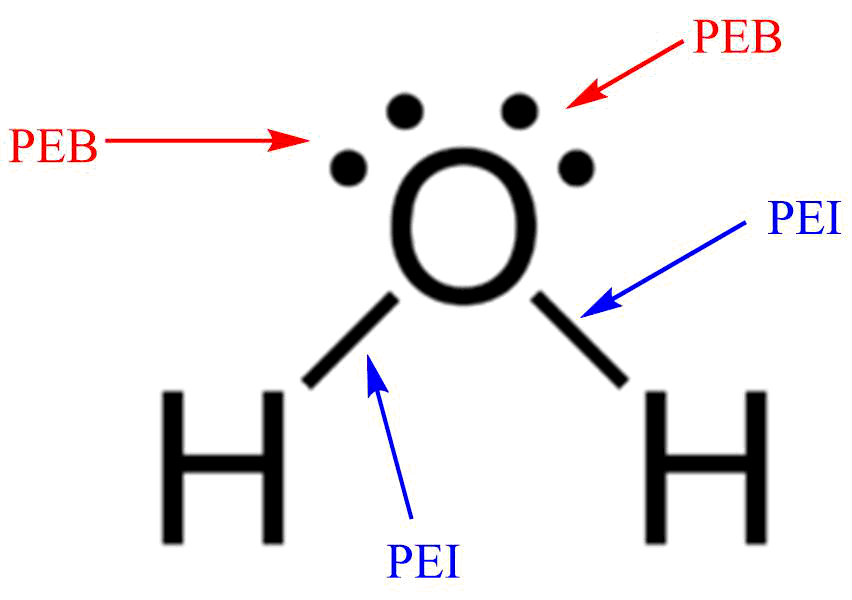
Disekitar atom pusat senyawa H2O terdapat 2 pasangan elektron bebas (PEB) dan 2 pasangan elektron ikat (PEI).
4. Sesuaikan dengan tabel notasi VSEPR dan bentuk molekul di bawah ini.
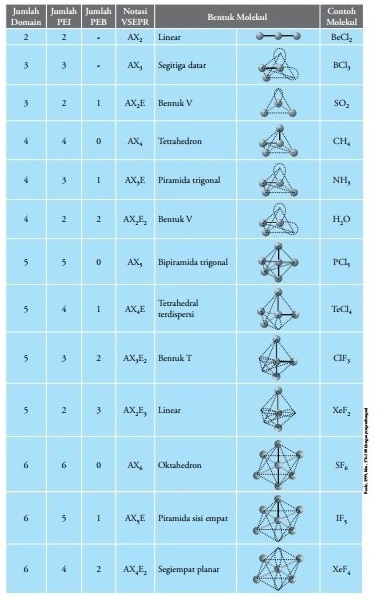
Molekul H2O memiliki notasi AX2E2, sehingga H2O diramalkan memiliki bentuk V atau bengkok.
2. Cara Menentukan Bentuk Molekul berdasarkan Teori Hibridisasi
Teori hibridisasi didasarkan pada mekanika kuantum dan merupakan perkembangan dari teori VSEPR. Bentuk molekul berdasarkan teori hibridisasi ditentukan dari penggabungan 2 atau lebih orbital atom.
Langkah-langkah untuk menentukan bentuk molekul berdasarkan teori hibridisasi. Misalnya kita akan menentukan bentuk molekul metana (CH4)
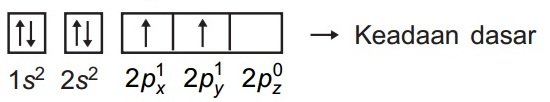
1. Tuliskan konfigurasi elektron atom pusat dalam keadaan dasar.
Pada molekul metana (CH4), atom C berperan sebagai atom pusat. Maka kita tuliskan konfigurasi elektron atom C dalam keadaan dasar sebagai berikut.
2. Tuliskan konfigurasi elektron atom pusat dalam keadaan tereksitasi
Karena atom C membentuk 4 ikatan kovalen, dapat dianggap bahwa 1 elektron dari orbital 2s dipromosikan ke orbital 2p, sehingga atom C mempunyai 4 elektron tunggal sebagai berikut.
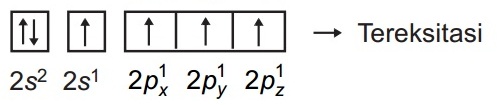
3. Tuliskan konfigurasi elektron yang terhibridisasi
Ketika atom karbon membentuk ikatan kovalen dengan atom H membentuk molekul CH4, orbital 2s dan ketiga orbital 2p mengalami hibridisasi membentuk 4 orbital yang setingkat.
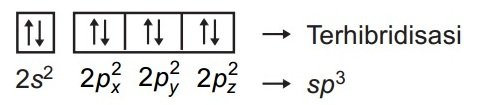
Orbital hibridanya ditandai dengan sp3 atau tetrahedron (bidang 4) untuk menyatakan asalnya, yaitu satu orbital s dan 3 orbital p.