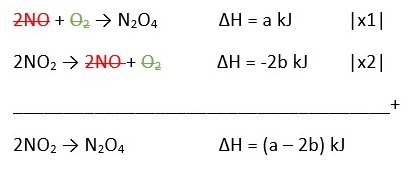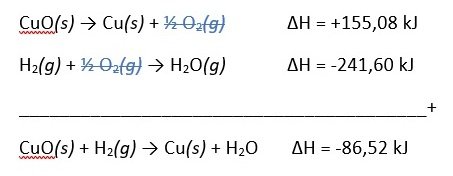Soal No. 11
Diketahui persamaan termokimia:
H2(g) + ½ O2(g) → H2O(l) ∆H = -242 kJ
Kalor reaksi untuk menguraikan 36 gram air (Ar H = 1, O = 16) adalah …. kJ
A. -484
B. -242
C. -121
D. +121
E. +484
Jawaban: A
Pembahasan:
Diketahui:
∆Hf = -242 kJ
Massa H2O = 36 gram
Mr H2O = 18
Ditanyakan: ∆Hd = …?
Jawaban:
n H2O = massa/Mr = 36/18 = 2 mol
Reaksi Penguraian 2 mol H2O:
2H2O → 2H2 + O2 ∆H = 2 x -242 = -484 kJ
Soal No. 12
Diketahui entalpi reaksi penguraian HBr adalah -36,2 kJ/mol. Energi ikatan rata-rata H – H dan Br – Br masing-masing 431 kJ/mol dan 188 kJ/mol, maka energi ikatan H – Br adalah …. kJ/mol.
A. -582,8
B. -291,4
C. +136,65
D. +291,4
E. +582,8
Jawaban: D
Pembahasan:
Reaksi penguraian HBr:
2HBr → H2 + Br2
∆Hr = ∑E Reaktan – ∑E Produk
-36,2 = 2(H – Br) – (H – H + Br – Br)
-36,2 = 2(H – Br) – (431 + 188)
2(H – Br) = -36,2 + 619
2(H – Br) = 582,8
H – Br = 582,8/2 = +291,4
Soal No. 13
Diketahui reaksi:
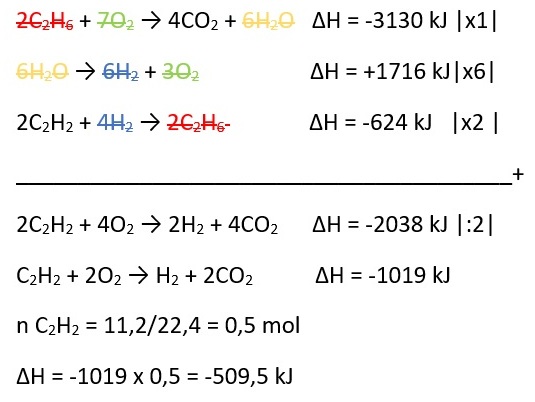
2C2H6(g) + 7O2 → 4CO2(g) + 6H2O(g) ∆H = -3130 kJ
H2(g) + ½ O2(g) → H2O(l) ∆H = -286 kJ
C2H2(g) + 2H2(g) → C2H6(g) ∆H = -312 kJ
Tentukan ∆H yang dibebaskan jika 11,2 liter gas C2H2 dibakar sempurna diukur pada keadaan standar adalah ….
A. -509,5 kJ
B. +509,5 kJ
C. -1864 kJ
D. +1864 kJ
E. -1305 kJ
Jawaban: A
Pembahasan:
Soal No. 14
Diketahui:
CS2(g) + 3O2(g) → CO2(g) + 2SO2(g) ∆H = -1110 kJ
CO2(g) → C(s) + O2(g) ∆H = +394 kJ
SO2(g) → S(s) + O2(g) ∆H = +297 kJ
Maka perubahan entalpi pembentukan CS2 adalah ….
A. +122 kJ
B. -122 kJ
C. +419 kJ
D. -419 kJ
E. +906 kJ
Jawaban: A
Pembahasan:
Soal No. 15
Diketahui energi ikatan rata-rata dalam kJ/mol dari:
C = C = 607
C – C = 343
C – H = 410
O – H = 460
C – O = 351
Perubahan entalpi dari reaksi:
CH2 = CH2 + H2O → CH2 – CH2 – OH
adalah ….
A. -111 kJ/mol
B. +111 kJ/mol
C. -37 kJ/mol
D. +37 kJ/mol
E. -74 kJ/mol
Jawaban: C
Pembahasan:
∆H = ∑E reaktan – ∑E produk
∆H = ((C = C) + 4(C – H) + 2(O – H)) – ((C – C) + 5(C – H) + (C – O) + (O – H))
∆H = (607 + 4(410) + 2(460)) – (343 + 5(410) + 351 + 460)
∆H = (607 + 1640 + 920) – (343 + 2050 + 351 + 460)
∆H = 3167 – 3204 = -37 kJ/mol
Soal No. 16
Diketahui persamaan termokimia berikut:
2NO(g) + O2(g) → N2O4(g) ∆H = a kJ
NO(g) + ½ O2(g) → NO2(g) ∆H = b kJ
Besarnya ∆H untuk reaksi
2NO2(g) → N2O4 adalah ….
A. (a + b) kJ
B. (a + 2b) kJ
C. (-a + 2b) kJ
D. (a – 2b) kJ
E. (2a + b) kJ
Jawaban: D
Pembahasan:
Soal No. 17
Jika diketahui perubahan entalpi untuk reaksi berikut:
2Fe(s) + 3/2O2(g) → Fe2O3(s) ∆H = +822 kJ/mol
C(s) + ½ O2(g) → CO(g) ∆H = -330 kJ/mol
Perubahan entalpi untuk reaksi:
3C(s) + Fe2O3(s) → 2Fe(s) + 3CO(g) adalah ….
A. -932 kJ/mol
B. -712 kJ/mol
C. -1812 kJ/mol
D. +492 kJ/mol
E. +712 kJ/mol
Jawaban: C
Pembahasan:
Soal No. 18
H2O(l) → H2(g) + ½ O2(g) ∆H = +68,3 kkal
H2(g) + ½ O2(g) → H2O(g) ∆H = -57,8 kkal
H2O(l) → H2O(s) ∆H = -1,4 kkal
Perubahan entalpi dari es menjadi uap adalah ….
A. -11,9 kkal
B. +11,9 kkal
C. -91,0 kkal
D. +9,1 kkal
E. +12,47 kkal
Jawaban: B
Pembahasan:
Soal No. 19
Diketahui:
CuO(s) → Cu(s) + ½ O2(g) ∆H = +155,08 kJ
H2(g) + ½ O2(g) → H2O(g) ∆H = -241,60 kJ
Maka perubahan entalpi untuk reaksi:
CuO(s) + H2 (g) → Cu(s) + H2O(g) adalah ….
A. +396,68 kJ
B. +86,52 kJ
C. -43,26 kJ
D. -86,52 kJ
E. -396,68 kJ
Jawaban: D
Pembahasan:
Soal No. 20
Diketahui:
∆H0f H2O(g) = -243 kJ/mol
∆H0f CO2(g) = -394 kJ/mol
∆H0f C2H2(g) = +52 kJ/mol
Jika 52 gram C2H2 dibakar secara sempurna sesuai dengan persamaan:
2C2H2(g) + 5O2(g) → 4CO2(g) + 2H2O(g)
Akan dihasilkan kalor sebesar …. (Ar C = 12; H = 1)
A. 391,2 kJ
B. 432,8 kJ
C. 1082 kJ
D. 2164 kJ
E. 4328 kJ
Jawaban: E
Pembahasan:
Reaksi setara:
2C2H2 + 5O2 → 4CO2 + 2H2O
∆HR = ∆H0f produk – ∆H0f reaktan
∆HR = (4 ∆H0f CO2 + 2 ∆H0f HO2) – (2 ∆H0f C2H2 + 5 ∆H0f O2)
∆HR = (4 (-394) + 2 (-242) – (2 (52) + 5 (0))
∆HR = -1576 – 484 – 104 = -2164 kJ
Jumlah mol C2H2 = gr/Mr = 52/26 = 2 mol
Q= 2164 kJ x 2 = 4328 kJ