Soal pilihan ganda dan pembahasan termokimia kelas xi berikut ini ditujukan supaya kamu dapat lebih memahami lebih dalam lagi mengenai materi termokimia. Termokimia itu sendiri merupakan cabang ilmu kimia yang mempelajari tentang kalor reaksi, yaitu pengukuran kalor yang menyertai reaksi kimia. Langsung saja simak pembahasan soal pilihan ganda termokimia berikut ini.
Soal No. 1
Jika diketahui:
H2(g) + Br2(g) → 2HBr(g) ∆H = -72 kJ, maka untuk dapat menguraikan 11,2 dm3 (pada STP) gas HBr menjadi H2 dan Br2 diperlukan kalor sebanyak …. kJ.
A. 9
B. 18
C. 36
D. 72
E. 144
Jawaban: B
Pembahasan:
Diketahui:
∆H0f = -72 kJ
V HBr = 11,2 dm3 = 11,2 Liter
Ditanyakan: ∆H0d 11,2 Liter HBr = …?
Jawaban:
Reaksi Penguraian HBr:
2HBr → H2 + Br2 ∆H = +72 kJ
n HBr = 11,2/22,4 = 0,5 mol
∆H0d 11,2 Liter HBr = (n HBr/ n HBr) x ∆H
∆H0d 11,2 Liter HBr = (0,5/2) x 72 = 18 kJ
Soal No. 2
Entalpi pembakaran C2H4 = a kJ/mol. Jika entalpi pembentukan CO2 dan H2O berturut-turut ialah b kJ/mol dan c kJ/mol, maka entalpi mebentukan C2H4(g) adalah …. kJ/mol
A. a – b + c
B. a – b – c
C. a – 2b + 2c
D. a + 2b + 2c
E. -a + 2b + 2c
Jawaban: E
Pembahasan:
Persamaan Reaksi:
C2H4 + 3O2 → 2CO2 + 2H2O ∆H = a
C + O2 → CO2 ∆H = b
2H2 + O2 → 2H2O ∆H = c
Reaksi pembentukan:
2C + 2H2 → C2H4 ∆H = …?
∆H = -a + 2b + 2c
Soal No. 3
Jika diketahui:
C(intan) + O2 → CO2(g) ∆H = -394,1 kJ
C(grafit) + O2 → CO2(g) ∆H = -396,0 kJ
Maka ∆H untuk reaksi C(grafit) → C(intan) adalah …. kJ.
A. +1,9
B. +0,95
C. -790
D. -1,9
E. +790
Jawaban: D
Pembahasan:
Soal No. 4
Dalam suatu reaksi kimia dibebaskan energi sebesar 2,73 kJ yang digunakan untuk memanaskan 50 mL air. Jika suhu mula-mula 290C dan berubah menjadi (29 + t)0C maka harga t adalah …. (kalor jenis air = 4,2 J/g0C).
A. 3,25
B. 6,50
C. 13
D. 26
E. 65
Jawaban: C
Pembahasan:
Diketahui:
∆H = Q = 2,73 kJ = 2730 J
m = ρ . V = 1 . 50 = 50 gram
∆T = (29 + t) – 29 = t0C
Ditanyakan = t = ….?
Jawaban:
Q = m . c . ∆T
2730 J = 50 gram . 4,2 J/gr0C . t0C
t = 2730 J/210 J = 13
Soal No. 5
Jika diketahui ∆H pembentukan gas karbon dioksida, uap air, dan gas propane, berturut-turut adalah -94,1 kkal; -57 kkal; -24,8 kkal, maka banyaknya panas yang dibebaskan pada pembakaran 1 gram gas propane adalah …. Kkal.
A. 11,1
B. 122,2
C. 183,3
D. 22,2
E. -485,5
Jawaban: E
Pembahasan:
Diketahui:
∆H CO2 = -94,1 kkal
∆H H2O = -57 kkal
∆H C3H8 = -24,8 kkal
Ditanyakan: ∆H0c = …?
Jawaban:
Reaksi:
C3H8 + 5O2 → 3CO2 + 4H2O
∆H0c = ∆H Produk – ∆H Reaktan
∆H0c = (3 x (-94,1) + 4 x (-57)) – (-24,8 + 5 x (0,00))
∆H0c = -282,3 -228 + 24,8 = -485,5
Soal No. 6
Diketahui:
∆Hf CO2 = -344 kJ/mol
∆Hf H2O = -286 kJ/mol
∆Hf CH3OH = -284 kJ/mol
Perubahan entalpi pada reaksi
CH3OH + O2 → CO2 + H2O (belum setara)
adalah …. kJ.
A. -346
B. -632
C. -914
D. -1264
E. -1828
Jawaban: D
Pembahasan:
2CH3OH + 3O2 → 2CO2 + 4H2O
∆H = ∆Hf produk – ∆Hf reaktan
∆H = ((2 x CO2) + (4 x H2O)) – (( 2 x CH3OH) + (3O2))
∆H = ((2 x -344) + (4 x -286)) – ((2 x -284) + (3 x 0))
∆H = -1832 + 568 = -1264 kJ
Soal No. 7
Diketahui energi ikatan:
N – H : 315 kJ/mol
N ≡ N : 945 kJ/mol
H – H : 433 kJ/mol
Kalor penguraian NH3 menurut reaksi
2NH3 → N2 + H2
adalah …. kJ/mol.
A. -97
B. +97
C. -194
D. +194
E. -138
Jawaban: E
Pembahasan:
Reaksi Setara:
2NH3 → N2 + 3H2
∆HR = ∑E reaktan – ∑E produk
∆HR = (2 x 3 x N – H) – (N≡N + (3 x H – H))
∆HR = (6 x 351) – (945 + (3 x 433))
∆HR = 2106 – 1378 = -138 kJ/mol
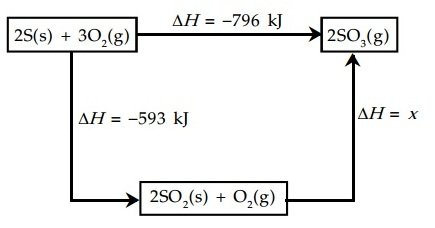
Soal No. 8
Perhatikan gambar siklus berikut.
Dari diagram tersebut harga x adalah …. kJ.
A. -203
B. +203
C. -406
D. +406
E. -812
Jawaban: A
Pembahasan:
∆HR = ∆H reaktan + ∆H produk
-796 kJ = -593 kJ + x
x = -796 + 593 = – 203 kJ
Soal No. 9
Apabila 100 mL larutan NaOH 1M direaksikan dengan 100 mL larutan HCl 1 M dalam sebuah bejana, ternyata suhu larutan naik dari 290C menjadi 370C. Jika kalor jenis larutan dianggap sama dengan kalor jenis air = 4,2 J/gr0C, maka perubahan entalpi reaksi
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) adalah …. kJ.
A. -4,50
B. -54,6
C. -67,2
D. -71,4
E. -82,3
Jawaban: C
Pembahasan:
Diketahui:
M NaOH = 1 M
M HCl = 1 M
V NaOH = 100 mL = 0,1 L
V HCl = 100 mL = 0,1 L
V total = 100 mL + 100 mL = 200 mL
T1 = 290C
T2 = 370C
∆T = T2 – T1 = 37 – 29 = 80C
c = 4,2 J/gr0C
Ditanyakan: ∆H = …?
Jawaban:
Persamaan reaksi:
NaOH + HCl → NaCl + H2O
n NaOH = M x V = 1 x 0,1 = 0,1 mol
n HCl = M x V = 1 x 0,1 = 0,1 mol
massa = ρ x Vtotal
massa = 1 x 200 = 200 gram
Q larutan = m . c . ∆T
Q larutan = 200 . 4,2 . 8 = 6720 J
∆H = -Q/n
∆H = – 6720/0,1 = -67200 J/mol = -67,2 kJ/mol
Soal No. 10
Diketahui reaksi:
2C2H2(g) + 5O2(g) → 4CO2(g) + 2H2O(l) ∆H = -2600 kJ
Jika entalpi pembentukan CO2 dan H2O masing-masing -393,5 kJ/mol dan -2866 kJ/mol, maka entalpi pembentukan C2H2 adalah …. kJ/mol
A. -227
B. -302
C. -452
D. +227
E. +452
Jawaban: D
Pembahasan:
Diketahui:
∆H CO2 = -393,5 kJ/mol
∆H H2O = -286 kJ/mol
∆Hf = -2600 kJ
Ditanyakan: ∆H C2H2 = ….?
Jawaban:
Reaksi:
2C2H2 + 5O2 → 4CO2 + 2H2O
∆Hf = ∆H produk – ∆H reaktan
∆Hf = ((4 x CO2) + (2 x H2O)) – ((2 x C2H2) + (5 x O2))
-2600 = ((4 x -393,5) + (2 x -286)) – (2 x ∆H C2H2) + (5 x 0)
-2600 = -1574 – 573 – (2 x ∆H C2H2)
2 x ∆H C2H5 = -2146 + 2600
∆H C2H5 = 454/2 = +227 kJ/mol