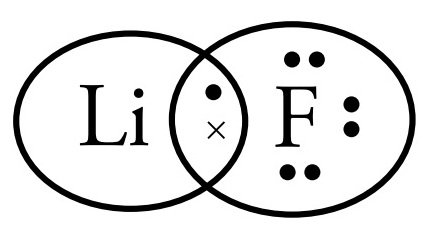Soal No. 1
Jelaskan secara singkat terbentuknya ikatan kimia pada senyawa NaCl.
Jawaban:
Susunan elektron pada unsur natrium (Na) dan klorin (Cl) yaitu:
11Na = 2 8 1
17Cl = 2 8 7
Untuk mencapai aturan oktet, unsur Na melepaskan 1 elektron dan unsur Cl menerima 1 elektron untuk mencapai aturan oktet. Jadi, antara Na dan Cl keduanya melakukan serah terima elektron untuk sehingga terbentuk senyawa NaCl.
Soal No. 2
Tentukan konfigurasi elektron dari unsur yang bersifat elektropositif berikut.
- Magnesium
- Natrium
- Aluminium
- Berilium
Jawaban:
- 12Mg = 2 8 2
- 11Na = 2 8 1
- 13Al = 2 8 3
- 4Br = 2 2
Soal No. 3
Tentukan konfigurasi elektron dari unsur yang bersifat elektronegatif berikut.
- Oksigen
- Fluor
- Iod
- Klor
- Brom
Jawaban:
- 8O = 2 6
- 9F = 2 7
- 53I = 2 8 18 18 7
- 17Cl = 2 8 7
- 35Br = 2 8 18 7
Soal No. 4
Tentukan susunan elektron valensi dan Struktur Lewis untuk unsur-unsur berikut.
- Hidrogen
- Oksigen
- Karbon
- Neon
- Aluminium
Jawaban:
Soal No. 5
Gambarkan Struktur Lewis pada senyawa LiF
Jawaban:
Langkah-langkah untuk menggambar Struktur Lewis adalah sebagai berikut.
- Tentukan konfigurasi elektron unsur yang akan berikatan.3Li = 2 1 dan 9F = 2 7
- Tentukan jumlah elektron pada kulit terluar. Li jumlah elektron valensinya = 1. F jumlah elektron valensinya = 7.
- Tentukan jumlah elektron valensi yang diperlukan setiap unsur untuk memenuhi aturan duplet atau oktet. Untuk memenuhi duplet Li memerlukan jumlah elektron valensi = 1. Untuk memenuhi oktet F memerlukan jumlah elektron valensi = 1.
Sehingga, gambar Struktur Lewis senyawa LiF adalah sebagai berikut.
Soal No. 6
Jelaskan pengertian ikatan kovalen dan ikatan kovalen koordinasi.
Jawaban:
- Ikatan kovalen adalah ikatan kimia yang terjadi karena penggunaan bersama pasangan elektron pada kulit terluar oleh unsur non-logam dengan unsur non-logam yang saling berikatan.
- Ikatan kovalen koordinasi adalah ikatan kimia yang terjadi karena elektron-elektron yang digunakan untuk berikatan berasal dari salah satu unsur yang berikatan.
Soal No. 7
Tentukan jenis ikatan dan sifat senyawa dari:
- MgO
- SF2
Untuk mempermudah menjawab pertanyaan, gunakan tabel keelektronegatifan Pauling.
Jawaban:
- Keelektronegatifan Mg = 1,3 dan O = 3,5. Mg merupakan unsur logam dan O unsur non-logam, sehingga ikatan kimia yang terbentuk adalah ikatan ion. Beda keelektronegatifannya adalah = 3,5 – 1,3 = 2,2. Sehingga sifat senyawa MgO adalah senyawa ionik, karena beda keelektronegatifannya >1,7.
- Keelektronegatifan S = 2,5 dan F = 4,1. S merupakan unsur logam dan F merupakan unsur non-logam, sehingga ikatan kimia yang terjadi adalah ikatan ion. Beda keelektronegatifannya adalah 4,1 – 2,5 = 1,6. Sehingga sifat senyawa SF2 adalah senyawa kovalen, karena beda keelektronegatifannya <1,7.