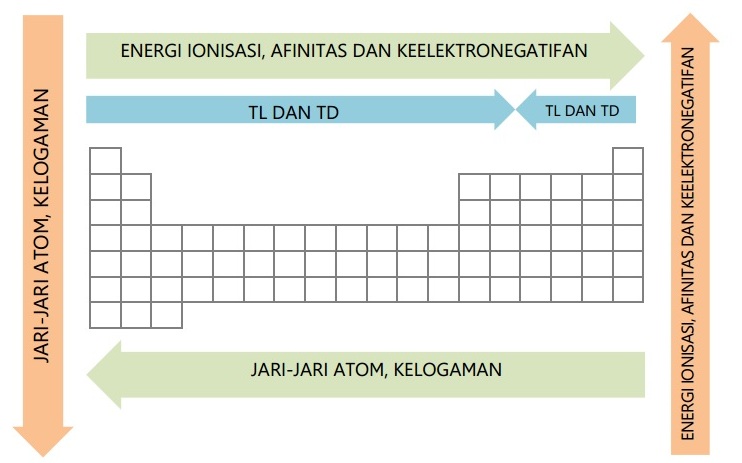
Sifat keperiodikan unsur adalah sifat – sifat unsur pada tabel periodik yang berubah secara teratur sesuai kenaikan nomor atom, baik dalam satu golongan maupun satu periode. Sifat keperiodikan unsur terbagi menjadi sifat fisis dan sifat kimia yang meliputi jari – jari atom, energi ionisasi, afinitas elektron, keeltronegatifan, kelogaman, titik leleh, dan titik didih.
1. Jari Jari Atom
Sifat keperiodikan unsur yang pertama yaitu jari – jari atom. Jari-jari atom adalah jarak antara inti atom dengan elektron terluar. Ukuran jari – jari atom dipengaruhi oleh jumlah kulit atom dan muatan inti atom.
- Semakin bertambah kulit atom, maka jari – jari atom semakin panjang
- Semakin bertambahnya elektron valensi atom, maka muatan inti semakin besar, sehingga memperpendek jari – jari atom.
Kecenderungan jari – jari atom dalam tabel periodik adalah sebagai berikut:
- Semakin ke bawah dalam satu golongan, jari – jari atom semakin panjang
- Semakin ke kanan dalam satu periode, jari – jari atom semakin pendek
Contoh jari – jari atom beberapa unsur (0A)
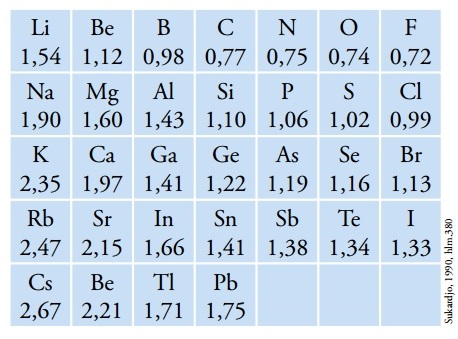
Jari – jari atom dapat dinyatakan dalam satuan picometer (pm) dan juga amstrong (0A). Dalam tabel periodik unsur, jari – jari atom terbesar dimiliki oleh fransium (Fr) dan jari jari terkecil dimiliki oleh helium (He).
2. Energi Ionisasi
Energi ionisasi adalah energi yang digunakan atom untuk melepaskan elektron. Besarnya energi ionisasi dipengaruhi oleh jari – jari atom dan muatan inti atom.
- Semakin besar nilai jari – jari atom, maka jarak elektron valensi ke inti atom semakin jauh.
- Jika jarak elektron valensi ke inti atom semakin jauh, maka muatan inti atom semakin kecil, hal tersebut mengakibatkan elektron semakin mudah untuk ditarik
- Jika elektron semakin mudah untuk ditarik oleh inti, maka energi ionisasi yang dibutuhkan semakin kecil.
Energi ionisasi dalam tabel periodik unsur
- Semakin ke bawah dalam satu golongan semakin kecil, karena jari – jari atom semakin besar dan gaya tarik menariknya semakin kecil
- Semakin ke kanan dalam satu periode semakin besar, karena jari – jari atom semakin kecil dan gaya tarik menariknya semakin besar.
Akan tetapi, energi ionisasi mengalami penyimpangan pada golongan IIA dan VA karena nilai energi ionisasi yang sangat besar, lebih besar dari golongan di sebelah kanannya, yaitu golongan IIIA dan VIA. Penyimpangan energi ionisasi disebabkan karena konfigurasi elektron pada golongan IIA, VA, dan VIIIA yang relatif stabil.
Contoh Energi Ionisasi Beberapa Unsur (Kkal/mol)
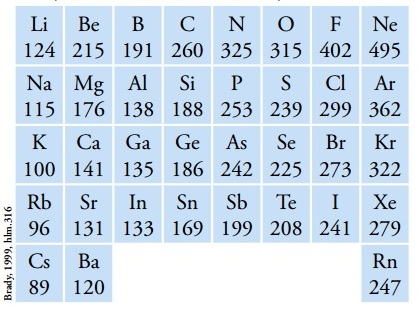
Energi ionisasi dinyatakan menggunakan satuan Kkal/mol atau kJ/mol atau eV. Pada tabel periodik unsur, energi ionisasi terbesar dimiliki helium (He) dan energi ionisasi terkecil dimiliki sesium (Cs).