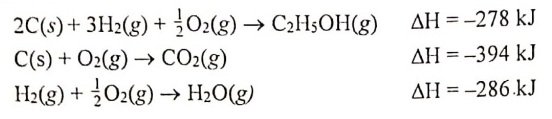Perubahan entalpi adalah perubahan panas dari suatu reaksi kimia yang terjadi pada suhu dan tekanan yang tetap. Perubahan entalpi juga dapat dikatakan sebagai selisih antara entalpi produk dengan entalpi reaktan. Sehingga perubahan entalpi hanya bergantung pada keadaan awal dan keadaan akhir.
Perhatikan soal pilihan ganda perubahan entalpi dan jawabannya berikut ini.
Soal No. 1
Apabila 1 mol CuSO4 dilarutkan dalam air terjadi perubahan entalpi sebesar ∆H = -57 kJ. Jika 40 gram CuSO4 (Mr = 160) dilarutkan ke dalam air, perubahan entalpinya ….
A. -57 kJ
B. -28 kJ
C. -14,25 kJ
D. -2,208 kJ
E. -185 kJ
Jawaban: C
Soal No. 2
Diketahui data energi ikat beberapa ikatan sebagai berikut
- C≡C: +839 kJ.mol-1
- C-C: +348 kJ.mol-1
- C-H: +413 kJ.mol-1
- H-H: +436 kJ.mol-1
Nilai ∆H untuk reaksi tersebut adalah …
A. -2000 kJ.mol-1
B. -1652 kJ.mol-1
C. -826 kJ.mol-1
D. -348 kJ.mol-1
E. -289 kJ.mol-1
Jawaban: E
Soal No. 3
Diketahui energi rata-rata:
H – H : 435 kJ/mol
N ≡ N : 946 kJ/mol
N – H : 390 kJ.mol
Kalor yang diperlukan untuk menguraikan 1,7 gram gas amoniak (Ar N = 14 g/mol; H = 1 g/mol) menjadi unsur-unsurnya adalah ….
A. 4,45 kJ
B. 8,9 kJ
C. 108,1 kJ
D. 1081 kJ
E. 1170 kJ
Jawaban: A
Soal No. 4
Diketahui data entalpi pembentukan standar sebagai berikut:
∆Hf0 CO2(g) = −394 kJ/mol
∆Hf0 H2O (g) = −286 kJ/mol
∆Hf0 C2H5OH(g) = −266 kJ/mol
Entalpi pembakaran standar dari pembakaran etanol menurut reaksi:
C2H5OH(g) + 3O2(g) → 2CO2(g) + 3H2O(g)
adalah ….
A. −1094 kJ/mol
B. −1380 kJ/mol
C. −1488 kJ/mol
D. −2986 kJ/mol
E. −2020 kJ/mol
Jawaban: B
Soal No. 5
Diberikan beberapa persamaan termokimia.
Besarnya perubahan entalpi pembakaran standar C2H5OH menurut reaksi:
C2H5OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g) adalah ….
A. -1368 kJ
B. -958 kJ
C. -402 kJ
D. +1368 kJ
E. +1922,20 kJ
Jawaban: A
Soal No. 6
Diketahui data energi ikatan rata-rata:
H – H = 436 kJ/mol
H – Cl = 431 kJ/mol
Cl – Cl = 242 kJ/mol
Besarnya perubahan entalpi pada penguraian 7,30 gram HCl (Mr = 36,5) menurut reaksi:
2HCl(g) → H2(g) + Cl2(g) adalah ….
A. -84 kJ
B. -18,4 kJ
C. +18,4 kJ
D. +36,8 kJ
E. +184 kJ
Jawaban: D
Soal No. 7
Diketahui reaksi pembentukan gas CO2 sebagai berikut:
C(s) + O2(g) → CO2(g) ∆H = -313,5 kJ
Besarnya perubahan entalpi (∆H) untuk penguraian 88 gram gas CO2 (Ar C = 12, O = 16) menjadi unsur-unsurnya adalah ….
A. -627,0 kJ
B. -313,5 kJ
C. -156,7 kJ
D. +313,5 kJ
E. +627,0 kJ
Jawaban: E
Soal No. 8
Diketahui reaksi-reaksi:
- C(s) + ½ O2(g) → CO(g) ∆H = -a kJ
- 2CO(s) + O2(g) → 2CO(g) ∆H = -b kJ
- C(s) + O2(g) → CO(g) ∆H = -c kJ
Menurut hukum Hess, hubungan antara a, b, dan c diberikan oleh ungkapan….
A. a = ½b + c
B. 2c = 2a + b
C. 2c = 2a + b
D. c = 2a + ½b
E. ½b = 2a + cc
Jawaban: C
Soal No. 9
Diketahui:
- 2H2(g) + O2(g) → 2H2O(l) ∆H = -572 kJ
- 2H2(g) + O2(g) → 2H2O(g) ∆H = -484 kJ
- H2O(l) → H2O(s) ∆H = -5,9 kJ
Perubahan entalpi dari es menjadi uap air adalah ….
A. +99,8 kJ
B. + 100 kJ
C. -99,8 kJ
D. -101 kJ
E. + 98,9 kJ
Jawaban: A
Soal No. 10
Jika reaksi P4 + 10Cl2 → 4PCl5 dilepaskan energi sebesar 1528,8 kJ maka ∆H pembentukan PCl5 adalah …. kJ/mol
A. -1528,8
B. -764,4
C. -382,2
D. -191,1
E. -185
Jawaban: C