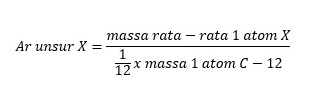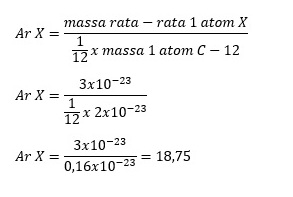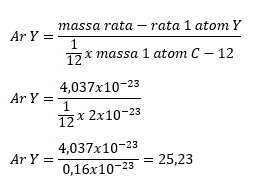Massa Atom Relatif (Ar)
Massa atom relatif adalah perbandingan massa rata-rata unsur X terhadap 1/12 x massa atom C-12, yang dirumuskan
Contoh Soal No. 1:
Massa rata-rata atom unsur X adalah 3×10-23 gr. Sedangkan massa 1 atom C-12 adalah 2×10-23 gr. Berapa massa atom relatif unsur X tersebut?
Pembahasan:
Diketahui:
massa rata-rata X = 3×10-23gr
massa atom C-12 = 2×10-23 gr
Ditanya Ar X =…?
Jadi, Ar X adalah 18,75
Contoh Soal No. 2:
Massa rata-rata 1 atom unsur Y adalah 4,037×10-23 gr. Sedangkan massa 1 atom C-12 adalah 2×10-23 gr. Berapakah massa Ar unsur Y tersebut?
Pembahasan:
Diketahui:
Massa rata-rata Y = 4,037×10-23 gr
Massa atom C-12 = 2×10-23 gr
Ditanya Ar Y = …?
Jawab:
Jadi, Ar Y adalah 25,23.
Selanjutnya, jika kita akan menentukan Ar suatu unsur yang berada di alam dalam bentuk isotop, maka digunakan rumus sebagai berikut.
Ar = (% 1 x massa isotop 1) + (% 2 x massa isotop 2) + …
Contoh Soal No. 3:
Isotop tembaga di alam terdiri atas 20% isotop Cu-65 dan 80% isotop Cu-63. Berapa massa atom relatif (Ar) tembaga?
Pembahasan:
Diketahui:
% 1 = 20%
% 2 = 80%
Massa isotop 1 = 65
Massa isotop 2 = 63
Ditanya Ar Cu…?
Jawab:
Ar Cu = (% 1 x massa isotop 1) + (% 2 x massa isotop 2)
Ar Cu = (20% x 65) + (80% x 63)
= (20 / 100 x 65) + (80/100 x 63)
= 63,4
Jadi massa atom relatif Cu sebesar 63,4.
Massa Molekul Relatif (Mr)
Massa molekul relatif (Mr) menyatakan jumlah massa atom relatif unsur-unsur penyusunnya.
Mr = ∑Ar
Contoh Soal No. 1
Hitung massa molekul relatif (Mr) H2O.
Pembahasan
Diketahui:
Senyawa H2O terbentuk dari 2 atom H dan 1 atom O.
Berdasarkan tabel periodik, diperoleh massa atom relatif unsur H dan O sebagai berikut.
Ar H = 1
Ar O = 16
Ditanya: Mr H2O…?
Jawab:
Mr H2O= ∑Ar
Mr H2O = (2 x Ar H) + (1 x Ar O)
= (2 x 1) + (1 x 16)
= 18
Contoh Soal No. 2
Berapa Mr dari HNO3? (Ar H = 1, N = 14, O = 16)
Pembahasan:
Diketahui:
Ar H = 1
Ar N = 14
Ar O = 16
Ditanyakan Mr HNO3…?
Jawab:
Mr HNO3 = ∑Ar
Mr HNO3 = (1 x Ar H) + (1 x Ar N) + (3 x Ar O)
Mr HNO3 = (1 x 1) + (1 x 14) + (3 x 16)
Mr HNO3 =1 + 14 + 48 = 63