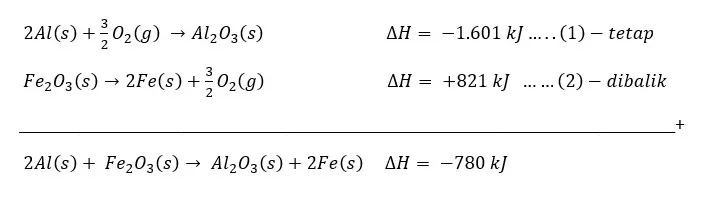Termokimia adalah bagian dari ilmu kimia yang mempelajari hubungan antara kalor (energi panas) dengan reaksi kimia atau proses-proses yang berhubungan dengan reaksi kimia. Untuk lebih mendalami materi termokimia, perhatikan contoh soal essay termokimia berikut ini.
Soal No. 1
Sepotong logam magnesium direaksikan dengan asam klorida encer pada sistem terbuka dengan reaksi:
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
Pada reaksi tersebut sistem melepas kalor sebesar 200 kJ dan menghasilkan gas yang akan menyebabkan terjadinya perubahan volume. Sistem juga melakukan kerja sebesar 50 kJ. Tentukan perubahan energi dalam (∆E) dalam proses tersebut!
Jawaban:
Diketahui:
q = – 200 kJ (karena sistem melepas kalor, maka q bertanda negatif)
w = – 50 kJ (karena sistem melakukan kerja, maka w bertanda negatif)
Ditanyakan: ΔE = …?
Jawaban:
ΔE = q + w
ΔE = -200 + (-50)
ΔE = – 250 kJ
Soal No. 2
Nilai perubahan entalpi pembakaran standar (∆Hc0) methanol (CH3OH) adalah – 638,5 kJ/mol. Tuliskan persamaan termokimiana!
Jawaban:
CH3OH(l) + 3/2 O2(g) → CO2(g) + 2H2O(g) ∆H = –638,5 kJ
Soal No. 3
Diketahui ∆Hc0 C = – 393,5 kJ/mol. Berapa kalor yang terjadi pada pembakaran 1 kg arah jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
Jawaban:
Diketahui:
∆Hc0 C = – 393,5 kJ/mol
massa C = (48/100) x 1000 gram = 480 gram
Jumlah mol = gr/Ar = 480/12 = 40 mol
Ditanyakan: q = ….?
Jawaban:
q = 40 mol x 393,5 kJ/mol
q = 15.740 kJ
Soal No. 4
Di dalam suatu kalorimeter bom direaksikan 0,16 gram gas metana (CH4) dengan oksigen berlebih sehingga terjadi reaksi berikut.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Ternyata terjadi kenaikan suhu 1,560C. Diketahui kapasitas kalor kalorimeter adalah 958 J/0C, massa air di dalam kalorimeter adalah 1.000 gram, dan kalor jenis air 4,18 J/g0C. Tentukan kalor pembakaran gas metana dalam kJ/mol. (Ar C = 12, H = 1)
Jawaban:
Kalor yang dilepas sistem sama dengan kalor yang diserap oleh air dalam kalorimeter dan oleh kalorimeter, maka:
qtotal = qsistem + qkalorimeter
qsistem = mair x cair x ∆T
qsistem = 1.000 g x 4,18 J/g0C x 1,560C = 6.520 J
qkalorimeter = Cp x ∆T
qkalorimeter = 958 J/0C x 1,560C = 1.494 J
maka:
qtotal = 6.520 J + 1.494 J = 8.014 J = 8,014 kJ
Jumlah mol CH4 = 0,16/16 = 0,01 mol
∆Hc0 = -(q/n) = – (8,014 kJ/0,01 mol = – 801,4 kJ/mol
Soal No. 5
Dalam suatu kalorimeter direaksikan 100 cm3 larutan NaOH 1 M dengan 100 cm3 larutan HCl 1 M. Ternyata suhunya naik dari 250C menjadi 310C. Kalor jenis larutan dianggap sama dengan kalor jenis air, yaitu 4,18 J/gK dan massa jenis larutan dianggap 1 g/cm3. Jika dianggap bahwa kalorimeter tidak menyerap kalor, tentukan perubahan entalpi dari reaksi:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Jawaban:
qtotal = qsistem + qkalorimeter
oleh karena kalorimeter tidak menyerap kalor, maka:
qtotal = qsistem
massa larutan = m NaOH + m HCl
massa larutan = 100 gram + 100 gram = 200 gram
∆T = 31 – 25 = 60C = 6K
qsistem = mlarutan x clarutan x ∆T
qsistem = 200 gram x 4,18 J/gK x 6 K
qsistem = 5.016 J = 5,016 kJ
NaOH = HCl = 0,1 L x 1 mol/L = 0,1 mol
Jadi, pada reaksi antara 0,1 mol NaOH dengan 0,1 mol HCl terjadi perubahan kalor sebesar 5,016 kJ.
Maka, untuk setiap 1 mol NaOH yang bereaksi dengan 1 mol HCl akan terjadi perubahan kalor sebesar:
5,016 kJ/0,1 mol = 50,16 kJ/mol
Oleh karena pada saat reaksi suhu sistem naik, maka reaksi berlangsung secara eksoterm dan perubahan entalpinya bernilai negatif. Persamaan termokimianya adalah sebagai berikut.
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) ∆H = – 50,16 kJ
Soal No. 6
Diketahui:
2Al(s) + 3/2 O2(g) → Al2O3(s) ∆H = – 1.601 kJ ……….. (1)
2Fe(s) + 3/2 O2(g) → Fe2O3(s) ∆H = – 821 kJ ……….. (2)
Hitunglah perubahan entalpi yang terjadi pada reaksi:
2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s) ……………………….…..(3)
Jawaban:
Soal No. 7
Diketahui:
∆Hf0 H2O(g) = – 242 kJ/mol
∆Hf0 CO2(g) = – 394 kJ/mol
∆Hf0 CH4(g) = – 84 kJ/mol
Hitunglah perubahan entalpi pembakaran (∆Hc0) CH4.
Jawaban:
Untuk menentukan perubahan entalpi pembakaran, maka reaksi pembakaran harus kita tuliskan terlebih dahulu.
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ∆Hc0= ?
∆H = ⅀∆Hf0 produk – ⅀∆Hf0 reaktan
∆H = (∆Hf0 CO2 + 2∆Hf0 H2O) – (∆Hf0 CH4 – 2∆Hf0 O2)
∆H = (-394 + 2(-242)) – (-84 + 2(0))
∆H = -394 – 484 + 84 – 0 = – 794 kJ
Soal No. 8
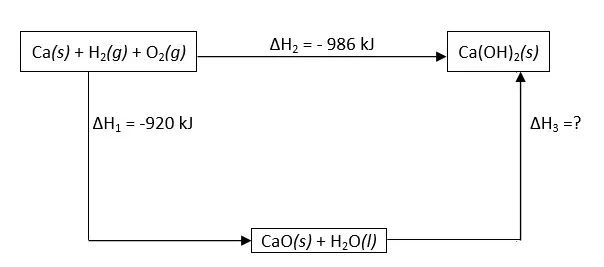
Diketahui siklus Hess sebagai berikut.
Dari siklus tersebut, tentukan perubahan entalpi reaksi:
CaO(s) + H2O(l) → Ca(OH)2 (s)
Jawaban:
∆H2 = ∆H1 + ∆H3
∆H3 = ∆H2 – ∆H1
∆H3 = – 986 kJ – (-920 kJ)
∆H3 = -982 + 920 = – 66 kJ
Soal No. 9
Dengan menggunakan data energi ikatan rata-rata. Hitunglah perubahan entalpi (∆H) reaksi berikut.
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Jawaban:
Ikatan yang putus:
4 ikatan C – H = 4 x 413 kJ = 1.652 k
1 ikatan Cl – Cl = 1 x 242 kJ = 242 kJ
Ikatan yang terbentuk:
3 ikatan C – H = 3 x 413 kJ = 1.239 kJ
1 ikatan C – Cl = 1 x 328 kJ = 328 kJ
1 ikatan H – Cl = 1 x 431 kJ = 431 kJ
∆H = ⅀energi pemutusan ikatan – ⅀energi penggabungan ikatan
∆H = (1.652 + 242) – (1.239 + 328 + 431)
∆H = 1.894 – 1.998
∆H = – 104 kJ
Soal No. 10
Diketahui energi disosiasi ikatan Cl – Cl pada molekul Cl2 adalah 243,4 kJ/mol dan H – H pada molekul H2 adalah 435,9 kJ/mol, serta ∆Hf0 HCl adalah – 92,3 kJ/mol. Berdasarkan data tersebut, hitunglah energi ikatan rata-rata H – Cl pada molekul HCl.
Jawaban:
Reaksi pembentukan HCl adalah:
½ H2(g) + ½ Cl2(g) → HCl(g) ∆Hf0 = – 92,3 kJ
Struktur ikatannya adalah:
½ H – H + ½ Cl – Cl → H – Cl
∆Hf0 = ( ½ Cl – Cl + ½ H – H ) – ( H – Cl )
-92,3 = ( ½ x 243,4 + ½ x 435,9) – (H – Cl)
-92,3 = 339,65 – (H – Cl)
H – Cl = 92,3 + 339,65 = 431,95 kJ/mol