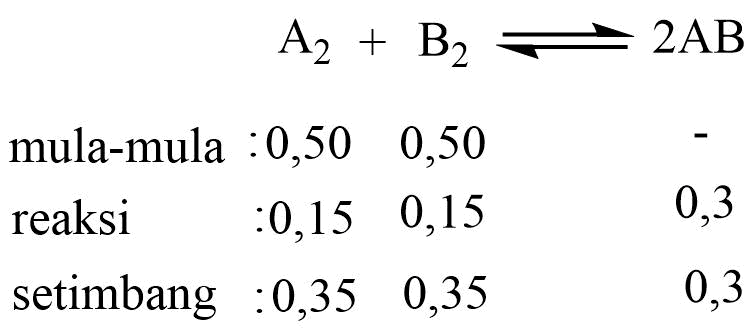Soal No. 21
Diketahui reaksi sebagai berikut:
A2(g) + B2(g) ⇆ 2AB(g)
Mula-mula direaksikan 0,5 mol A2 dengan 0,5 mol B2 dalam ruang 1 liter pada suhu 270C. Ternyata setelah kesetimbangan tercapai terdapat 0,3 mol gas AB. Jika tekanan total gas pada reaksi itu adalah 10 atm, nilai Kp untuk reaksi tersebut adalah ….
A. 0,30
B. 0,35
C. 0,73
D. 2,3
E. 3,5
Pembahasan:
mol total saat setimbang = 0,35 + 0,35 + 0,3 = 1 mol
Jadi, nilai Kp untuk reaksi tersebut adalah 0,73. Jawaban C.
Soal No. 22
Perhatikan persamaan reaksi berikut!
- NH3(g) + BF3(g) → NH3BF3(g)
- H3PO4(aq) → H+(aq) + H2PO4–(aq)
- PO43-(aq) + H2O(l) ⇆ HPO42-(aq) + H+(aq)
Urutan yang sesuai dengan konsep asam-basa Arrhenius, Bronsted-Lowry, dan Lewis adalah …
A. 1, 2, 3
B. 2, 1, 3
C. 2, 3, 1
D. 3, 1, 2
E. 3, 2, 1
Pembahasan:
Arrhenius
asam adalah zat yang melepaskan H+ dan basa adalah zat yang melepaskan OH–. Berdasarkan reaksi di atas, yang merupakan asam-basa Arrhenius adalah H3PO4(aq) → H+(aq) + H2PO4–(aq).
Bronsted-Lowry
asam adalah zat yang mendonorkan proton dan basa adalah akseptor proton. Berdasarkan reaksi di atas, yang merupakan asam-basa Bronsted-Lowry adalah PO43-(aq) + H2O(l) ⇆ HPO42-(aq) + H+(aq).
Lewis
asam adalah zat yang kekuarang elektron dan basa adalah zat yang kelebihan elektron. Berdasarkan reaksi di atas, yang merupakan asam-basa Lewis adalah NH3(g) + BF3(g) → NH3BF3(g).
Jadi, urutan yang sesuai dengan konsep asam-basa Arrhenius, Bronsted-Lowry, dan Lewis adalah 2, 3, 1. Jawaban C.
Soal No. 23
Perhatikan data hasil uji terhadap 2 jenis larutan dengan menggunakan 4 jenis indikator!
No | Nama Indikator | Trayek pH | Perubahan Warna | Pengamatan | |
Larutan X | Larutan Y | ||||
1 | metil merah | 4,2 – 6,3 | merah – kuning | kuning | merah |
2 | metil jingga | 3,2 – 4,4 | merah – kuning | kuning | jingga |
3 | metil ungu | 4,8 – 5,4 | ungu – hijau | hijau | ungu |
4 | lakmus | 4,7 – 8,3 | merah – biru | biru | merah |
Perkiraan pH untuk larutan X dan larutan Y secara berurutan adalah ….
A. 3,2 – 4,4 dan 5,8 – 8,3
B. 4,4 – 4,8 dan 4,7 – 5,4
C. 4,8 – 5,4 dan 4,4 – 4,8
D. 4,7 – 8,3 dan 3,2 – 4,0
E. 8,3 – 14,0 dan 3,2 – 4,2
Pembahasan:
Larutan X
metil merah : pH ≥ 6,3
metil jingga :pH ≥ 4,4
metil ungu : pH ≥ 5,4
lakmus : pH ≥ 8,3
Jadi kisaran pH X = 8,3 – 14.
Larutan Y
metil merah: pH ≤ 4,2
metil jingga: 3,2 ≤ pH ≤ 4,4
metil ungu : pH ≤ 4,8
lakmus : pH ≤ 4,7
Jadi,kisaran pH Y = 3,2 – 4,2
Jadi, perkiraan pH untuk larutan X dan larutan Y secara berurutan adalah 8,3 – 14,0 dan 3,2 – 4,2. Jawaban E.
Soal No. 24
Perhatikan data hasil titrasi asam dengan larutan asam asetat 0,15 M berikut!
Percobaan | Volume Ba(OH)2 | Volume CH3COOH 0,15 M |
1 | 30 mL | 39,8 mL |
2 | 30 mL | 40,0 mL |
3 | 30 mL | 40,2 mL |
Berdasarkan data tersebut, massa Ba(OH)2 yang bereaksi adalah…. (Ar Ba = 56 gram.mol–; O = 16 gram.mol–; H = 1 gram.mol–).
A. 0,54 gram
B. 0,30 gram
C. 0,27 gram
D. 0,15 gram
E. 0,10 gram
Pembahasan
Diketahui:
V Ba(OH)2 = (30 + 30 + 30)/3 = 30 mL
Mr Ba(OH)2 = 56 + 2 (16+1) = 90
n Ba(OH)2 = 2 [jumlah ion OH–)
V CH3COOH = (39,8 + 40 + 40,2)/3 = 40 mL
M CH3COOH = 0,15 M
n CH3COOH = 1 (jumlah ion H+)
Ditanya: massa Ba(OH)2 …?
Jawab:
M1 . V1 . n1 = M2 . V2 . n2
M1 . 30 . 2 = 0,15 . 40 . 1
M1 . 60 = 6
M1 = 6/60 = 0,1 M
Jadi, assa Ba(OH)2 yang bereaksi adalah 0,27 gr. Jawaban C.
Soal No. 25
Perhatikan tabel data yang belum lengkap dari hasil uji hidrolisis larutan garam berikut ini!
No | Larutan | Uji Lakmus | Jenis Hidrolisis | Persamaan reaksi hidrolisis | |
Merah | Biru | ||||
1 | (NH4)2SO4 | merah | merah | … | NH4+ + H2O ⇆ NH4OH + H+ |
2 | NaF | … | biru | parsial | F– + H2O ⇆ HF + OH– |
3 | HCOOK | biru | biru | parsial | … |
Data yang tepat untuk mengisi bagian titik-titik pada nomor 1, 2, dan 3 berturut-turut adalah ….
A | parsial | merah | HCOO– + H2O ⇆ OH– + HCOOH |
B | parsial | biru | HCOO– + H2O ⇆ OH– + HCOOH |
C | total | biru | NH4OH + HCOOH ⇆ NH4+ + HCOO– + H2O |
D | parsial | merah | NH4+ H2O ⇆ NH4OH + H+ |
E | total | merah | HCOO– + H2O ⇆ OH– + HCOOH |
Pembahasan
(NH4)2SO4 merupakan senyawa asam yang berasal dari basa lemah NH4OH dan asam kuat H2SO4, sehingga jenis hidrolisisnya termasuk hidrolisis parsial.
NaF merupakan senyawa basa yang berasal dari basa kuat NaOH dan asam lemah HF, sehingga pada uji lakmus akan menunjukkan warna biru.
HCOOK merupakan senyawa basa yang berasal dari basa kuat KOH dan asam lemah HCOOH sehingga persamaan reaksi hidrolisisnya adalah
HCOO– + H2O ⇆ OH– + HCOOH
Jadi, data yang tepat untuk mengisi bagian titik-titik pada nomor 1, 2, dan 3 berturut-turut adalah parsial, biru, dan HCOO– + H2O ⇆ OH– + HCOOH. Jawaban B.
Soal No. 26
Sebanyak 100 mL H2SO4 0,1 M dicampur dengan 100 mL larutanNH3 0,2 M. Jika Kb NH3 = 1 x 10-5, pH campuran yang terbentuk adalah …
A. 5 − log 2
B. 5 + log 1
C. 5 + log 2
D. 5,5 + log 5
E. 6,5 − log 1
Pembahasan:
Diketahui:
V H2SO4 = 100 mL; M H2SO4 = 0,1 M
V NH3 = 100 mL; M NH3 = 0,2 M
Kb NH3 = 1 x 10-5
Ditanya: pH…?
Jawab:
n H2SO4 = V x M =100 mL x 0,1 M = 10 mmol
n NH3 = V x M = 100 mL x 0,2 M = 20 mmol
Reaksi:
[H+] = 10-5
pH = -log [H+]
pH = -log 10-5
pH = 5 + log 1
pH campuran yang terbentuk adalah 5 + log 1. Jawaban B.
Soal No. 27
Sebanyak 100 mL AgNO3 0,01 M dicampur dengan 100 mL H2SO4 0,01 M. Diketahui Ksp Ag2SO4 = 3,2 . 10-5. Pernyataan yang benar mengenai campuran tersebut adalah …
A. terbentuk endapan karena Ksp < Qc
B. terbentuk endapan karena Ksp > Qc
C. belum terbentuk endapan karena Ksp < Qc
D. belum terbentuk endapan karena Ksp > Qc
E. larutan tepat jenuh karena Ksp = Qc
Pembahasan:
Diketahui:
V AgNO3 = 100 mL; M AgNO3 = 0,01 M
V H2SO4 = 100 mL; M H2SO4 = 0,01 M
V AgNO3 + V H2SO4 = 100 mL
Ksp Ag2SO4 = 3,2 . 10-5
Ditanya: pernyataan yang benar …?
Jawab:
2AgNO3 + H2SO4 → Ag2SO4 + 2HNO3
Ag2SO4 → 2Ag+ + SO42-
Qc = [Ag+]2[SO42-]
Qc = (5.10-3)2. 5.10-3
Qc = 125.10-9 = 0,0125 . 10-5
Ksp > Qc
karena Ksp > Qc maka belum terbentuk endapan.
Jadi, pernyataan yang benar mengenai campuran tersebut adalah belum terbentuk endapan karena Ksp > Qc. Jawaban D.
Soal No. 28
Diberikan 4 zat berikut:
- garam
- oksigen
- air
- susu
Zat yang apabila dicampur akan menghasilkan koloid emulsi adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 3
D. 2 dan 4
E. 3 dan 4
Pembahasan:
Koloid emulsi adalah jenis koloid yang memiliki fase tersdispersi cair. Koloid emulsi dibagi menjadi tiga bagian, yaitu:
- Emulsi padat, contohnya: keju
- Emulsi cair, contohnya: susu
- Emulsi gas, contohnya: kabut
Jadi, zat yang apabila dicampur akan menghasilkan koloid emulsi adalah air dan susu. Jawaban E.
Soal No. 29
Diketahui contoh koloid dalam kehidupan sehari-sehari sebagai berikut:
- Mayonnaise
- Agar-agar
- Asap
- Buih sabun
- Kabut
Pasangan koloid yang memiliki fasa terdispersi sama adalah ….
A. 1 dan 3
B. 1 dan 5
C. 2 dan 4
D. 2 dan 5
E. 3 dan 5
Pembahasan:
- Mayonnaise, fase terdispersi cair
- Agar-agar, fase terdispersi cair
- Asap, fase terdispersi padat
- Buih sabun, fase terdispersi gas
- Kabut, fase terdispersi cair
Jadi, pasangan koloid yang memiliki fasa terdispersi sama adalah 1, 2, dan 5. Jawaban B/D.
Soal No. 30
Diberikan tabel tentang sifat koloid
No | Peristiwa Sehari-hari | Sifat Koloid |
1 | proses cuci darah | elektroforesis |
2 | kabut di pegunungan | efek Tyndall |
3 | pembentukan delta di muara sungai | koagulasi |
4 | pemutihan gula | liofil |
5 | proses kerja obat diare | adsorbsi |
Pasangan data yang tepat adalah …
A. 1 dan 3
B. 1 dan 4
C. 2 dan 4
D. 2 dan 5
E. 3 dan 5
Pembahasan:
- Elektroforesis, contohnya dalam kehidupan sehari-hari adalah identifikasi DNA dan kelainanan genetik, dan Cottrell.
- Efek Tyndall, contohnya dalam kehidupan sehari-hari adalah langit berwarna biru pada siang hari dna sorot lampu pada kabut.
- Koagulasi, contohnya dalam kehidupan sehari-hari adalah penjernihan air, pembentukan delta di muara suangai, dan penggumpalan asap pabrik.
- Liofil, contohnya dalam kehidupan sehari-hari adalah kanji dan agar-agar.
- Adsorbsi, contohnya dalam kehidupan sehari-hari adalah pemutihan gula pasir, bahan aktif deodorant, dan penyembuhan diare.
Jadi, pasangan data yang tepat adalah nomor 3 dan 5. Jawaban E.
Pelajari Juga: