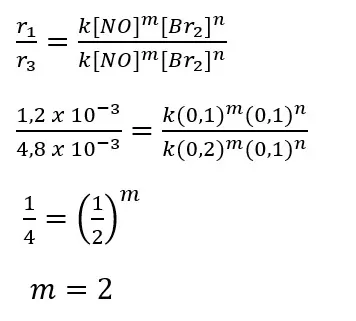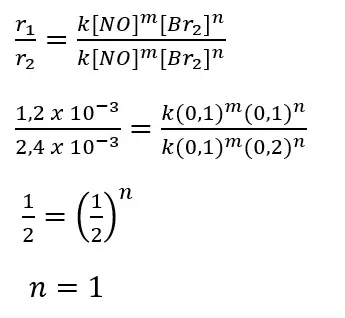Orde reaksi atau tingkat reaksi terhadap suatu komponen merupakan pangkat dari konsentrasi komponen tersebut dalam hukum laju. Orde reaksi dan tetapan laju reaksi dapat ditentukan melalui eksperimen. Perhatikan contoh soal berikut!
Gas nitrogen monoksida dan gas brom bereaksi pada 00C menurut persamaan reaksi
2NO(g) + Br2(g) → 2NOBr(g)
Laju reaksinya diikuti dengan mengukur pertambahan konsentrasi NOBr dan diperoleh data sebagai berikut.
| Percobaan Ke | [NO] (M) | [Br2] (M) | Kecepatan awwal pembentukan NOBr (M/detik) |
| 1 | 0,1 | 0,1 | 1,2 x 10-3 |
| 2 | 0,1 | 0,2 | 2,4 x 10-3 |
| 3 | 0,2 | 0,1 | 4,8 x 10-3 |
| 4 | 0,3 | 0,1 | 1,08 x 10-4 |
Tentukan:
- Orde reaksi terhadap gas NO
- Orde reaksi terhadap gas Br2
- Orde reaksi total
- Rumus Laju reaksinya
- Tetapan kecepatan laju reaksi
Pembahasan:
1. Orde reaksi terhadap gas NO
Untuk menentukan orde reaksi terhadap NO kita gunakan data percobaan 1 dan 3 dengan langkah perhitungan sebagai berikut.
Jadi, orde reaksi terhadap gas NO adalah 2.
2. Orde reaksi terhadap gas Br2
Kita gunakan percobaan 1 dan 2 untuk menentukan orde reaksi terhadap gas Br2.
Jadi, orde reaksi terhadap gas Br2 adalah 1.
3. Orde reaksi total
Orde reaksi total = orde reaksi terhadap gas NO + orde reaksi terhadap gas Br2
Orde reaksi total = 2 + 1 = 3
4. Rumus Laju reaksinya
r = k [NO]2[Br2]1
5. Tetapan kecepatan laju reaksi
Kita gunakan data percobaan 1 untuk menentukan kecepatan laju reaksi dengan langkah-langkah sebagai berikut.
r = k [NO]2[Br2]1
1,2 x 10-3 = k (0,1)2(0,1)1
1,2 x 10-3 = k . 0,001
k = 1,2 x 10-3 / 0,001
k = 1,2