Perbedaan nomor atom, nomor massa, dan isotop adalah sebagai berikut:
1. Nomor Atom
Semua atom dapat diidentifikasikan berdasarkan jumlah proton dan neutron yang terdapat di dalam inti atom. Jumlah proton dalam inti atom disebut nomor massa (Z). Dalam atom netral jumlah proton sama dengan jumlah elektron, sehingga nomor atom juga menandakan jumlah elektron yang ada di dalam atom.
Sebagai contoh, nitrogen netral memiliki nomor atom 7, itu artinya nitrogen tersebut mempunyai 7 proton dan 7 elektron.
2. Nomor Massa
Nomor massa (A) adalah jumlah total neutron dan proton yang ada di dalam inti atom. Secara umum, nomor massa dapat dirumuskan sebagai berikut:
nomor massa = jumlah proton + jumlah neutron
atau
nomor massa = nomor atom + jumlah neutron
Sebagai contoh, flourin memiliki nomor massa 19 dan nomor atomnya 9. Itu artinya, jumlah neutron dalam satu atom flourin adalah 19 – 9 = 10.
3. Isotop
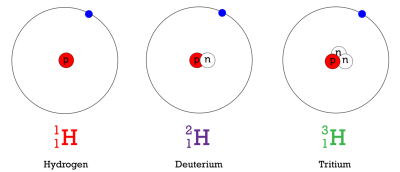
Isotop adalah atom – atom yang mempunyai nomor atom yang sama tetapi nomor massanya berbeda. Sebagai contoh, hidrogen memiliki tiga isotop.
- Isotop pertama, dikenal sebagai hidrogen, mempunyai satu proton dan tidak mempunyai neutron.
- Isotop kedua, dikenal sebagai deutreum, mempunyai satu proton dan satu neutron.
- Isotop ketiga, dikenal sebagai tritium, mempunyai satu proton dan dua neutron.
Untuk lebih mudahnya, kita dapat menuliskan ketiga isotop – isotop tersebut sebagai berikut:
Itulah perbedaan nomor atom, nomor massa, dan isotop.