Struktur Atom
Menjelang abad ke-19 dengan ditemukannya elektron dan gejala radioaktivitas, maka atom bukan lagi partikel terkecil yang tidak dapat dibagi lagi. Melainkan atom itu mengandung sejumlah partikel sub-atomik yang disebut sebagai struktur atom. Struktur atom ini terdiri dari elektron, proton, dan neutron. Akan tetapi, setelah dilakukan penelitian lebih lanjut, di dalam atom juga terdapat partikel-partikel lain yang terdiri atas positron, neutrino, dan meson. Partikel-partikel lain ini biasanya diperoleh selama terjadi perubahan-perubahan.
1. Elektron
Elektron adalah partikel penyususn atom yang bermuatan negatif.
Sejarah Penemuan Elektron
- 1807 Davy menduga bahwa gaya listriklah yang membuat senyawa-senyawa saling berikatan
- 1833 Faraday menghubungkan massa atom dengan energi listrik yang dibutuhkan untuk menghasilkan suatu unsur selama percobaan elektrolisis
- 1891 Stoney mengajukan teori bahwa listrik dalam atom terdapat dalam bentuk yang disebut elektron
- 1897 Thomson pertama kali mengukur sifat elektron secara kuantitatif
Berdasarkan hasil percobaan menggunakan sinar katoda yang dilakukan oleh Thomson, elektron dihasilkan ketika suatu gas terionisasi.
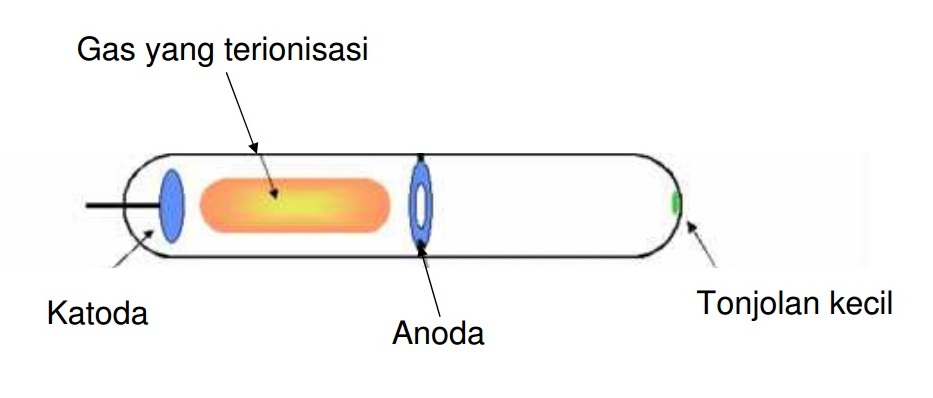
Thomson mengamati bahwa posisi tonjolan kecil menjadi berubah ketika medan listrik maupun medan magnet diterapkan pada tabung sinar katoda.
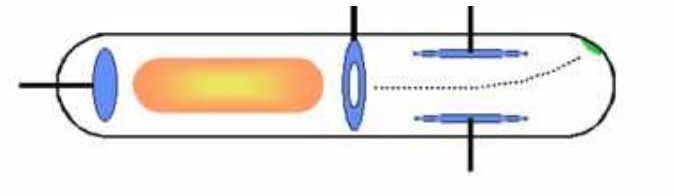
Akan tetapi, Thomson tidak bisa menemukan massa maupun muatan elektron. Thomson hanya bisa menentukan rasio massa terhadap muatan sebesar 6 x 10-12 kg/C.
Muatan Elektron
Percobaan Millikan menggunakan tetesan minyak yang diberikan arus listrik menunjukkan bahwa tetesan minyak memiliki muatan yang merupakan kelipatan dari 1,5924 x 10-19 C => muatan elektron. Namun, muatan elektron yang digunakan sekarang sebesar -1,6021773 x 10-19C.
Massa Elektron
Massa elektron dihitung dari hasil percobaan Thomson dan Millikan, yaitu dari rasio massa elektron terhadap muatan elektron (Thomson) dan muatan elektron (Millikan), sehingga:
Me = rasio massa terhadap muatan elektron x muatan elektron
Me = (6 x 10-12 kg/C) x (1,5924 x 10-19C) = 1 x 10-30 kg
Namun, massa elektron yang digunakan sekarang adalah 9,109390 x 10-31 kg, atau setara dengan 5,489 x 10-4 satuan massa atom. Berdasarkan prinsip kesetaraan massa energi Einstein, massa elektron setara dengan energi rihat 0,511 MeV.
2. Proton dan Neutron
Oleh karena elektron merupakan partikel penyusun atom bermuatan negatif, berarti harus ada partikel lain yang bermuatan positif. Rutherford adalah orang pertama yang mengembangkan satuan dasar bermuatan positif yang disebut proton.
Moseley yang bekerjasama dengan Rutherford menemukan hubungan langsung antara nomor atom dengan akar kuadrat dari frekuensi sinar X. Yang diperoleh kesimpulan bahwa muatan inti atom sama dengan elektron, hanya berbeda tanda muatan saja.
Kemudian pada tahun 1932 Chadwick mengamati bahwa ketika berilium-9 ditembaki partikel alfa, ternyata partikel yang masanya sama dengan proton tapi tanpa muatan dilepaskan, inilah yang disebut neutron.