Larutan asam kuat dan basa kuat terbentuk ketika senyawa asam kuat atau basa kuat dilarutkan ke dalam air.
pH Larutan Asam Kuat
Jika senyawa asam kuat yang dilarutan ke dalam air maka dapat terbentuk larutan asam kuat dan meningkatkan konsentrasi ion H+ dalam larutan. Hal tersebut terjadi karena senyawa asam kuat dapat terionisasi sempurna di dalam air sehingga mengganggu kesetimbangan air. Semakin besar konsentrasi ion H+ maka larutan tersebut semakin asam dengan ditandai semakin kecil nilai pHnya. Konsentrasi ion H+ tersebut hanya ditentukan oleh konsentrasi dari asam kuat.
Rentang pH larutan asam kuat yaitu lebih kecil dari 3.
pH Larutan Basa Kuat
Sedangkan jika senyawa basa kuat dilarutan dalam air maka akan membentuk larutan basa kuat. Adanya ion OH– dari senyawa basa kuat akan menggeser kesetimbangan air ke kiri. Akibatnya, konsentrasi OH– dari air jauh lebih kecil dibandingkan konsentrasi OH– basa kuat, sehingga konsentrasi OH– dari air dapat diabaikan. Semakin besar konsentrasi OH– dalam larutan maka larutan tersebut semakin basa dengan ditandai semakin besar nilai pHnya.
Rentang pH larutan basa kuat yaitu lebih besar dari 11.
Untuk lebih mudahnya, perhatikan penentuan pH larutan asam basa dengan menggunakan indikator universal berikut ini.
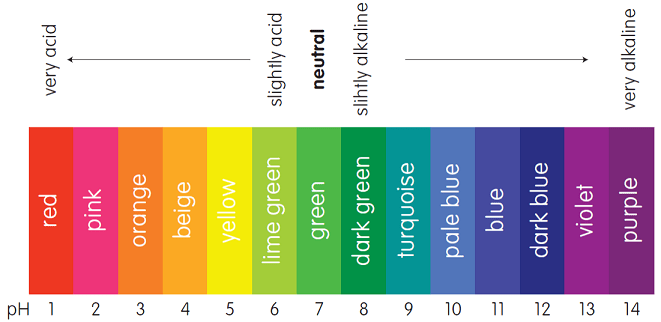
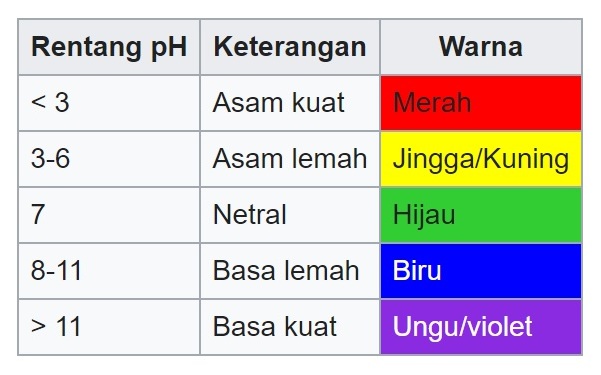
Warna larutan dari merah hingga kuning merupakan larutan asam, hijau adalah netral, dan hijau tua sampai ungu termasuk larutan basa.