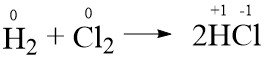Reaksi redoks adalah peristiwa yang melibatkan reaksi reduksi dan oksidasi yang berlangsung secara bersamaan. Ada dua zat yang berperan dalam reaksi redoks yaitu oksidator dan reduktor. Oksidator adalah zat yang menyebabkan teradinya oksidasi dan zat ini mengalami reduksi. Sedangkan reduktor adalah zat yang menyebabkan terjadinya reduksi dan zat ini mengalami oksidasi.
Untuk lebih memahami materi reaksi redoks, perhatikan contoh soal essay reaksi redoks dan pembahasannya berikut ini.
Soal No. 1
Tuliskan bilangan oksidasi dari unsur yang dicetak tebal berikut.
- besi (II) sulfat
- mangan (III) oksida
Pembahasan:
1. besi (II) sulfat (FeSO4)
FeSO4 = (1 x biloks Fe) + (1 x biloks S) + (4 x biloks O)
0 = (1 x Fe) + (1 x 6) + (4 x (-2))
0 = Fe + 6 – 8
Fe = +2
2. mangan (III) oksida (Mn2O3)
Mn2O3 = (2 x biloks Mn) + (3 x biloks O)
0 = (2 x Mn) + (3 x (-2))
0 = 2Mn – 6
2Mn = 6
Mn = 6/2 = +3
Soal No. 2
Kelompokkanlah reaksi-reaksi berikut ini ke dalam reaksi redoks atau bukan redoks.
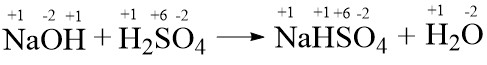
- NaOH(aq) + H2SO4(aq) → NaHSO4(aq) + H2O(l)
- H2(g) + Cl2(g) → 2HCl(g)
Pembahasan:
Bukan reaksi redoks. Karena tidak mengalami perubahan bilangan oksidasi.
Termasuk reaksi redoks. Karena terjadi perubahan bilangan oksidasi.
Soal No. 3
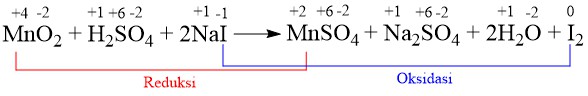
Pada reaksi redoks:
MnO2(s) + 2H2SO4(aq) + 2 NaI(aq) → MnSO4(aq) + Na2SO4(aq) + 2H2O(l) + I2(s)
Tentukanlah yang berperan sebagai oksidator pada reaksi tersebut.
Pembahasan:
Jadi, yang berperan sebagai oksidator pada reaksi tersebut adalah Mn.
Soal No. 4
Setarakan reaksi redoks berikut.
Pb(s) + PbO2(s) + SO42-(aq) → PbSO4(aq)
Pembahasan:
Pb(s) + PbO2(s) + 4H+(aq) + 2SO42-(aq) → PbSO4(aq) + 2H2O(l)
Soal No. 5
Pada reaksi:
Zn(s) + 2MnO2(s) + 2NH4+(aq) → Zn2+(aq) + Mn2O3(s) + 2NH3(aq) + H2O(l)
Manakah yang berperan sebagai reduktor dan mana yang oksidator?
Pembahasan:
Reduktor: Mn
Oksidator: NH4+
Soal No. 6
Jelaskan pengertian reaksi redoks menurut tiga konsep perkembangan reaksi redoks!
Pembahasan:
- Pengertian reaksi redoks berhubungan dengan oksigen adalah reaksi pengikatan dan pelepasan oksigen.
- Pengertian reaksi redoks berhubungan dengan elektron adalah reaksi pelepasan dan penerimaan elektron.
- Pengertian reaksi redoks berdasarkan bilangan oksidasi adalah reaksi pertambahan dan penurunan bilangan oksidasi.
Soal No. 7
Tentukan bilangan oksidasi unsur yang digarisbawahi pada senyawa-senyawa berikut ini!
- NH4+
- H3PO4
- Cu(NO3)2
- NH4NO2
Pembahasan:
1. NH4+
NH4+ = (1 x biloks N) + (4 x biloks H+)
+1 = (1 x N) + (4 x 1)
+1 = N + 4
N = +1 – 4 = -3
2. H3PO4
H3PO4 = (3 x biloks H) + (1 x biloks P) + (4 x biloks O)
0 = (3 x 1) + (1 x P) + (4 x (-2))
0 = 3 + P + -8
P = 8 – 3 = +5
3. Cu(NO3)2
Cu(NO3)2 = (1 x biloks Cu) + (2 x biloks NO3–)
0 = (1 x Cu) + (2 x (-1)
0 = Cu – 2
Cu = +2
NO3– = (1 x biloks N) + (3 x biloks O)
-1 = N + (3 x (-2))
-1 = N – 6
N = 6 – 1 = +5
4. NH4NO2
NH4+ = (1 x biloks N) + (4 x biloks H)
+1 = N + (4 x 1)
+1 = N + 4
N = +1 – 4 = -3
Jadi, biloks N dalam NH4+ = -3
NO2– = (1 x biloks N) + (2 x biloks O)
-1 = N + (2 x (-2)
-1 = N – 4
N = -1 + 4 = +3
Jaddi, biloks N dalam NO2– = +3
Soal No. 8
Tentukan reaksi berikut tergolong reaksi redoks atau bukan redoks!
- 2NaOH + H2SO4 → Na2SO4 + 2H2O
- 2Fe + 6HCl → 2FeCl3 + 3H2
- Pb(NO3)2 + 2KI → PbI2 + 2KNO3
- I2 + H2S → 2HI + S
Pembahasan:
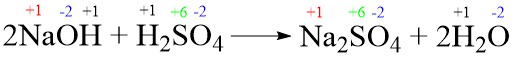
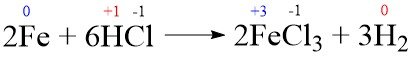
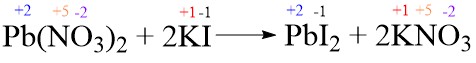
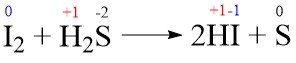
Soal No. 9
Reaksi berikut berdasarkan konsep pengikatan dan pelepasan oksigen termasuk reaksi apa?
- Si + O2 → SiO2
- 2Ag2O → 4Ag + O2
Pembahasan:
- Si + O2 → SiO2 = termasuk reaksi oksidasi karena mengikat oksigen
- 2Ag2O → 4Ag + O2 = termasuk reaksi reduuksi karena melepas oksigen
Soal No. 10
Berilah contoh kegunaan reaksi redoks dalam kehidupan sehari-hari!
Pembahasan:
Contoh kegunaan reaksi redoks dalam kehidupan sehari-hari yaitu:
- Pada metode lumpur aktif terjadi reaksi oksidasi untuk pertumbuhan bakteri aerob dan terjadi reaksi reduksi pada substrat atau buangan.
- Pada berbagai bidang industri digunakan sebagai pelapisan dan pengolahan logam.
- Reaksi redoks juga digunakan dalam aki dan baterai sebagai sumber energi listrik.
- Konsep reaksi redoks juga diterapkan dalam proses penyepuhan emas.