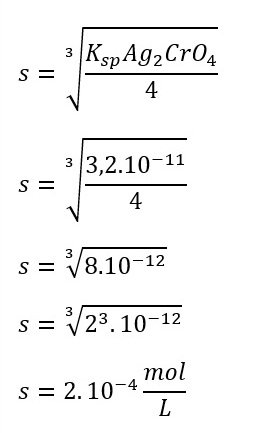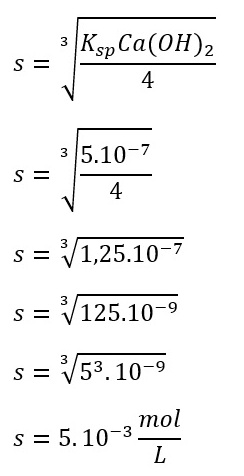Berikut kami sajikan 10 contoh soal kelarutan dan hasil kali kelarutan beserta jawabannya. Pelajari dengan senang yah…. Jangan dibuat sulit.
Contoh Soal Kelarutan dan Hasil Kali Kelarutan No.1-5
Soal No. 1
Diketahui Ksp Ag2CrO4 = 3,2 . 1011. Hitunglah kelarutan Ag2CrO4 dalam air.
Pembahasan
Diketahui:
Ksp Ag2CrO4 = 3,2 . 1011
Ditanya: s Ag2CrO4 =…?
Jawaban:
Reaksi : Ag2CrO4(s) ⇌ 2Ag+(aq) + CrO42-(aq)
Kelarutan: s 2s s
Ksp Ag2CrO4 = [Ag+]2[CrO2-]
Ksp Ag2CrO4 = (2s)2 s
Ksp Ag2CrO4 = 4s3
Jadi, kelarutan Ag2CrO4 dalam air sebesar 2.10-4 mol/L.
Soal No. 2
Apa yang terjadi jika 100 ml larutan NaCl 0,01 M ditambahkan ke dalam 100 ml larutan AgNO3 0,001 M. Jika diketahui Ksp AgCl = 1,44.10-9.
Pembahasan
Diketahui:
V NaCl = 100 ml; M NaCl = 0,01 M
V AgNO3 = 100 ml; M AgNO3 = 0,001 M
Ksp AgCl = 1,44.10-9
Ditanya: reaksi…?
Jawab:
n NaCl = V x M = 100 ml x 0,01 M = 1 mmol
n AgNO3 = V x M = 100 ml x 0,001 M = 0,1 mmol
∑V = V NaCl + V AgNO3 = 100 ml + 100 ml = 200 ml
Reaksi: AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
[Ag+] = [AgNO3] = n AgNO3/∑V
[Ag+] = 0,1 mmol/200 mL = 0,0005 M
[Cl–] = [NaCl] = n NaCl/∑V
[Cl–] = 1 mmol/200 mL = 0,005 M
Qc = [Ag+] [Cl–]
Qc = (0,0005) (0,005)
Qc = (5.10-4) (5.10-3)
Qc = 2,5.10-8
Qc > Ksp = 2,5.10-8 > 1,44.10-9
karena Qc > Ksp, maka akan AgCl akan mengendap.
Soal No. 3
Diketahui kelarutan Mg(OH)2 (Mr = 58) dalam air pada suhu 250C = 58 mgram per liter. Berapa Ksp Mg(OH)2?
Pembahasan:
Diketahui:
Kelarutan Mg(OH)2 = 58 mgram = 0,058 gram
Mr = 58
T = 250C
V air = 1L
Ditanya:
Ksp …?
Jawab:
n Mg(OH)2 = 0,058/58 = 0,001 mol
s = n/V = 0,001 mol/1L = 0,001 mol/L = 10-3mol/L
Reaksi : Mg(OH)2(s) ⇌ Mg2+(aq) + 2OH–(aq)
Kelarutan: s s 2s
Ksp Mg(OH)2 = [Mg2+][OH–]2
Ksp Mg(OH)2 = s (2s)2
Ksp Mg(OH)2 = 4s3
Ksp Mg(OH)2 = 4 (10-3)3 = 4 x 10-9
Jadi, Ksp Mg(OH)2 sebesar 4.10-9.
Soal No. 4
Diketahui Ksp Ca(OH)2 = 5.10-7. Berapakah pH larutan jenuh Ca(OH)2 ?
Pembahasan
Diketahui:
Ksp Ca(OH)2 = 5.10-7
Ditanya: pH larutan jenuh Ca(OH)2…?
Jawab:
Reaksi : Ca(OH)2(s) ⇌ Ca2+(aq) + 2OH–(aq)
Kelarutan : s s 2s
Ksp Ca(OH)2 = [Ca2+][OH–]2
Ksp Ca(OH)2 = s (2s)2
Ksp Ca(OH)2 = 4s3
[OH–] = 2s
[OH–] = 2 (5.10-3)
[OH–] = 10-2
pOH = -log [OH–]
pOH = -log 10-2
pOH = 2
pH = 14 – pOH
pH = 14 – 2 = 12
Jadi, pH larutan jenuh Ca(OH)2 sebesar 2.
Soal No. 5
Jika Ksp AgCl = 10-12. Hitunglah kelarutan AgCl dalam:
a. air murni
b. larutan NaCl 0,001 M
c. larutan NaCl 0,01 M
Pembahasan
Diketahui:
Ksp AgCl = 10-12
Ditanya:
a. kelarutan AgCl dalam air murni …?
b. kelarutan AgCl dalam larutan NaCl 0,001 M …?
c. kelarutan AgCl dalam larutan NaCl 0,01 M …?
Jawab:
Reaksi : AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
Kelarutan : s s s
a. kelarutan AgCl dalam air murni
Ksp = [Ag+][Cl–]
Ksp = (s) (s)
Ksp = s2
s = √Ksp
s = √1012
s = 10-6 mol/L
b. kelarutan AgCl dalam NaCl 0,001 M
Reaksi : NaCl(s) ⇌ Na+(aq) + Cl–(aq)
Kelarutan : 0,001 0,001 0,001
Reaksi : AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
Kelarutan : s s s
[Cl–] = s + 0,001
karena s sangat kecil, maka s diabaikan. Sehingga
[Cl–] = 0,001 M
[Ag+] = s M
Ksp = [Ag+][Cl–]
10-12 = (s) . 0,001
10-12 = s.10-3
S = 10-9 mol/L
c. kelarutan AgCl dalam NaCl 0,01 M
Reaksi : NaCl(s) ⇌ Na+(aq) + Cl–(aq)
Kelarutan : 0,01 0,01 0,01
Reaksi : AgCl(s) ⇌ Ag+(aq) + Cl–(aq)
Kelarutan : s s s
[Cl–] = s + 0,01
karena s sangat kecil, maka s diabaikan. Sehingga
[Cl–] = 0,01 M
[Ag+] = s M
Ksp = [Ag+][Cl–]
10-12 = (s) . 0,01
10-12 = s.10-2
S = 10-10 mol/L
Jadi, kelarutan AgCl dalam air murni, NaCl 0,001 M, NaCl 0,01 M sebesar 10-6 mol/L, 10-9 mol/L, dan 10-10 mol/L.