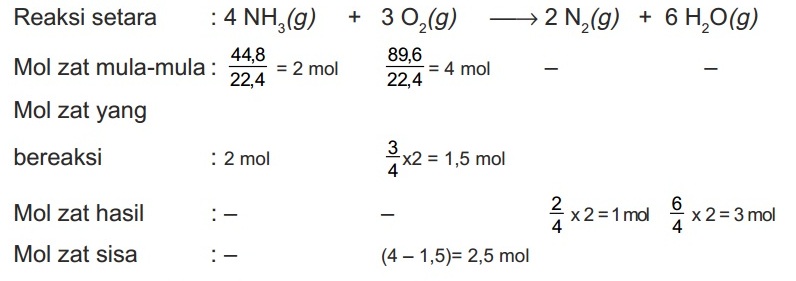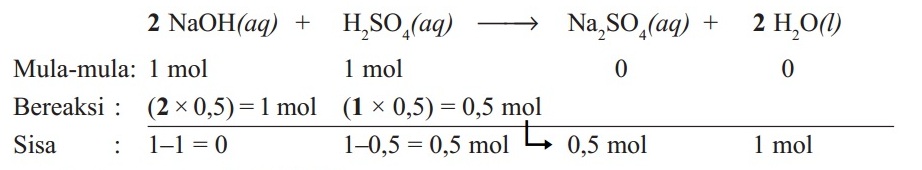Pereaksi pembatas dan pereaksi berlebih dalam reaksi kimia dapat ditemukan ketika kita mereaksikan dua zat atau lebih, namun ada salah satu zat yang habis terlebih dahulu. Zat yang habis terlebih dahulu itu dinamakan sebagai pereaksi pembatas dan zat yang tidak sepenuhnya habis bereaksi dinamakan pereaksi berlebih. Untuk lebih jelasnya, perhatikan contoh soal pereaksi pembatas dan pereaksi berlebih berikut ini!
Soal No. 1
108 gram aluminium dibakar dengan 160 gram gas oksigen untuk membentuk aluminium oksida Al2O3. Berapa gram Al2O3 terbentuk ddan massa unsur yang tersisa? (Ar Al = 27, O = 16)
Pembahasan:
Reaksi: 4 Al(s) + 3O2(g) → 2Al2O3(s)
n Al = gr/Ar = 108/27 = 4 mol
n O2 = gr/Ar = 160/32 = 5 mol
4 mol Al akan tepat bereaksi dengan 3 mol O2 menghasilkan 2 mol Al2O3
Itu artinya,
O2 yang tersisa = 5 mol – 3 mol = 2 mol
massa O2 yang tersisa = n O2 x Mr O2 = 2 x 32 = 64 gram
massa Al2O3 yang terbentuk = n Al2O3 x Mr Al2O3 = 2 x 102 = 204 gram
Jadi, massa Al2O3 yang terbentuk sebanyak 204 gram dan massa O2 yang tersisa sebanyak 64 gram
Soal No. 2
Di dalam bejana tertutup, 44,8 L gas NH3 direaksikan dengan 89,6 L gas O2 pada STP dengan reaksi: 4NH3(g) + 3O2(g) → 2N2(g) + 6H2O(g)
- Hitung volume gas N2 yang dihasilkan
- Hitung volume H2O yang dihasilkan
- Hitung volume gas yang tersisa
Pembahasan:
- Volume gas N2 hasil = 1 x 22,4 L = 22,4 L
- Volume gas H2O hasil = 3 x 22,4 L = 67,2 L
- Volume gas O2 sisa = 2,5 x 22,4 L = 56 L
Soal No. 3
Sebanyak 10 gram tembaga direaksikan dengan 20 gram belerang dengan reaksi:
Cu(s) + S(s) → CuS(s)
(Ar Cu = 63,5 dan S = 32)
- Manakah pereaksi pembatasnya?
- Berapa gram CuS yang terbentuk?
- Manakah zat yang tersisa dan berapa gram massanya?
Pembahasan:
n Cu = gr/Ar = 10/63,5 = 0,157 mol
n S = gr/Ar = 20/32 = 0,625
Karena koefisien Cu dan S dalam persamaan reaksi kimia di atas sama-sama bernilai 1 maka:
Cu : S = (0,157/1) : (0,625/1)
Cu : S = 0,157 : 0,625
Itu artinya Cu akan habis bereaksi terlebih dahulu sebelum S sehingga Cu berperan sebagai pereaksi pembatas.
n CuS = (koefisien CuS/koefisien Cu) x n Cu
n CuS = (1/1) x 0,157 = 0,157 mol
massa CuS = 0,157 x 95,5 = 14,99 gram
n S yang bereaksi = 0,157 mol
massa S yang bereaksi = 0,157 x 32 = 5,024 gram
massa S yang tersisa = 20 – 5,024 = 14,976 gram
- Pereaksi pembatas adalah Cu
- Massa CuS yang terbentuk sebanyak 14,99 gram
- Zat yang tersisa adalah S dan massa S yang tersisa = 14,976 gram
Soal No. 4
Senyawa H2SO4 yang mempunyai massa 49 gram direaksikan dengan 20 gram NaOH. Berapakah Na2SO4 yang dihasilkan? Diketahui Ar H =1, S = 32, O = 16.
Pembahasan:
Reaksi:
H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)
Jumlah mol Na2SO4 = 49/98 = 0,5 mol
Jumlah mol NaOH = 20/40 = 0,5 mol
Perbandingan jumlah mol NaOH dengan H2SO4 adalah (5/2) : (5/1).
NaOH : H2SO4 = 2,5 : 5
Jadi, NaOH akan habis bereaksi dan berperan sebagai pereaksi pembatas. Sehingga kita dapat menghitung massa Na2SO4 yang dihasilkan.
Massa Na2SO4 = 0,25 x Mr Na2SO4 = 0,25 x 142 = 35,5 gram.
Jadi, massa Na2SO4 yang dihasilkan sebanyak 35,5 gram.
Soal No. 5
Gas ammonia sebanyak 2,24 L (STP) direaksikan dengan 3,2 gram gas oksigen. Reaksinya:
NH3(g) + O2(g) → NO(g) + H2O(g)
(Ar N = 14, H = 1, O = 16)
Tentukan:
- Persamaan reaksi setara!
- Pereaksi pembatas!
- Massa pereaksi tersisa!
- Voluume NO yang terbentuk pada STP!
Pembahasan:
1. Persamaan reaksi setara!
Persamaan reaksi setara:
4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
2. Pereaksi Pembatas
Jumlah mol NH3 = 2,24/22,4 = 0,1 mol
Jumlah mol O2 = 3,2/32 = 0,1 mol
Perbandingan jumlah mol
NH3 : O2 = (0,1/4) : (0,1/5) = 0,025 : 0,02
Karena O2 lebih kecil maka O2 berperan sebagai pereaksi pembatas. Sehingga NH3 mempunyai sisa.
3. Massa Pereaksi Tersisa
Jumlah mol NH3 yang bereaksi = (koefisien NH3/koefisien O2) x n O2 = (4/5) x 0,1 = 0,08 mol
Jumlah mol NH3 yang tersisa = 0,1 – 0,08 = 0,02 mol
Massa NH3 yang tersisa = n NH3 sisa x Mr = 0,02 x 17 = 0,34 gram
4. Volume NO yang terbentuk pada STP
Jumlah mol NO = (Koefisien NO/Koefisien O2) x n O2 = (4/5) x 0,1 = 0,08 mol
V NO (STP) = n NO x Vm = 0,08 x 22,4 = 1,792 L
Soal No. 6
Satu mol laruutan natrium hidroksida (NaOH) direaksikan dengan 1 mol larutan asam sulfat (H2SO4) sesuai reaksi:
2NaOH(aq) + H2SO4(aq) → Na2SO4(aq) + 2H2O(l)
Tentukan:
- Pereaksi pembatas
- Pereaksi yang sisa
- Mol Na2SO4 dan mol H2O yang dihasilkan
Pembahasan:
1. Pereaksi Pembatas
Karena NaOH habis terlebih dahulu maka NaOH adalah pereaksi pembatas.
2. Pereaksi yang sisa adalah H2SO4
3. Mol Na2SO4 dan mol H2O yang dihasilkan
Jumlah mol Na2SO4 yang dihasilkan = 0,5 mol
Jumlah mol H2O yang dihasilkan = 1 mol
Soal No. 7
100 mL larutan Ca(OH)2 0,1 M direaksikan dengan 100 mL larutan HCl 0,1 M sesuai reaksi:
Ca(OH)2(aq) + 2HCl(aq) → CaCl2(aq) + 2H2O(l)
Tentukan pereaksi pembatas!
Pembahasan:
Jumlah mol Ca(OH)2 = M x V = 0,1 M x 0,1 L = 0,01 mol
Jumlah mol HCl = M x V = 0,1 M x 0,1 L = 0,01 mol
Ca(OH)2 : HCl = (0,01/1) : (0,01/2)
Ca(OH)2 : HCl = 0,01 : 0,005
Dari perbandingan tersebut, maka HCl akan habis bereaksi terlebih dahulu sehingga HCl berperan sebagai pereaksi pembatas.
Soal No. 8
Perhatikan persamaan reaksi berikut.
N2(g) + 3H2(g) → 2NH3(s)
Jika 1 mol N2 direaksikan dengan 2 mol H2, tentukan:
- Pereaksi pembatas
- Jumlah mol yang tersisa
- Jumlah mol NH3
Pembahasan:
1. Pereaksi Pembatas
Jumlah mol N2/Koefisien reaksi N2 = 1/1 = 1 mol
Jumlah mol H2/koefisien reaksi H2 = 2/3 = 0,67 mol
N2 : H2 = 1 : 0,67
Jadi, H2 akan habis bereaksi terlebih dahulu sehingga H2 berperan sebagai pereaksi pembatas.
2. Jumlah mol yang tersisa
Jumlah mol N2 yang tersisa = 1 – 0,67 = 0,33 mol
3. Jumlah mol NH3
Jumlah mol NH3 = (koefisien NH3/koefisien H2) x mol H2
Jumlah mol NH3 = (2/3) x 2 = 1,33 mol
Soal No. 9
Perhatikan persamaan reaksi berikut.
4Fe + 3O2 → 2Fe2O3
Jika 2 mol Fe direaksikan dengan 4 mol O2. Tentukan:
- Pereaksi pembatas
- Jumlah mol Fe2O3
- Jumlah mol tersisa
Pembahasan:
1. Pereaksi Pembatas
Jumlah mol Fe /Koefisien reaksi Fe = 2/4 = 0,5 mol
Jumlah mol O2/koefisien reaksi O2 = 4/3 = 1,33 mol
Fe : O2 = 0,5 : 1,33
Jadi, Fe akan habis bereaksi terlebih dahulu sehingga Fe berperan sebagai pereaksi pembatas.
2. Jumlah mol Fe2O3
Jumlah mol Fe2O3 = (koefisien Fe2O3/koefisien Fe) x mol Fe
Jumlah mol Fe2O3 = (2/4) x 0,5 = 0,25 mol
3. Jumlah mol yang tersisa
Jumlah mol O2 yang tersisa = 1,33 – 0,5 = 0,83 mol
Soal No. 10
Logam magnesium dengan massa 3 gram direaksikan dengan larutan asam klorida yang mengandung HCl 40 gram. Reaksi yang terjadi adalah:
Mg(s) + HCl(aq) → MgCl2(aq) + H2(g) (belum setara)
Tentukan:
- Pereaksi pembatas
- Gas hydrogen yang dihasilkan, diukur pada 270C, 1 atm.
Pembahasan:
Reaksi setara:
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
1. Pereaksi pembatas
Jumlah mol Mg = 3/24 = 0,125
Jumlah mol HCl = 40/36,5 = 1,095
Jumlah mol Mg/Koefisien reaksi Mg = 0,125/1 = 0,125
Jumlah mol HCl/Koefisien reaksi HCl = 1,095/2 = 0,5475
Mg : HCl = 0,125 : 0,5475
Jadi, Mg akan habis bereaksi terlebih dahulu sehingga Mg berperan sebagai pereaksi pembatas.
2. Gas Hidrogen yang dihasilkan pada suhu 270C, 1 atm
T = 270C = 300K
PV = nRT
1 x V = 0,125 x 0,082 x 300
V = 3,075 L