A. Soal Pilihan Ganda
Soal No. 1
Atom unsur yang akan membentuk ikatan ion dengan atom unsu X yang bernomor atom 17 adalah….
A. 6C
B. 8O
C. 11Na
D. 14Si
E. 16S
Jawaban: C
Pembahasan:
Kita lihat dulu konfigurasi elektron milik X, yaitu sebagai berikut.
17X = 2 8 7 (kekurangan 1 elektron)
Karena X kekurangan 1 elektron, maka kita harus nyari unsur yang melepaskan 1 elektron. Caranya, kita tuliskan konfigurasi elektron dari setiap unsur pada jawaban.
A. 6C = 2 4 (kekurangan 4 elektron)
B. 8O = 2 6 (kekurangan 2 elektron)
C. 11Na = 2 8 1 (kelebihan 1 elektron)
D. 14Si = 2 8 4 (kekurangan 4 lektron)
E. 16S = 2 8 6 (kekurangan 2 elektron)
Soal No. 2
Unsur -unsur yang terdapat pada golongan VIIA akan berikatan ion dengan unsur-unsur yang terletak pada ….
A. Golongan IA dan IIA
B. Golongan IA dan IVA
C. Golongan IIA dan IVA
D. Golongan IVA dan VA
E. Golongan VA dan VIA
Jawaban: A
Pembahasan:
Ikatan ion terjadi antara unsur logam dengan unsur non-logam. Golongan VIIA merupakan golongan unsur non-logam, sedangkan golongan IA dan IIA merupakan golongan unsur logam.
Soal No. 3
Ikatan ion terdapat pada pasangan senyawa ….
A. NaCl dan HCl
B. HCl dan NH3
C. NH3 dan SO3
D. SO3 dan KOH
E. KOH dan NaCl
Jawaban: E
Pembahasan:
A. NaCl dan HCl (ikatan ion dan ikatan kovalen )
B. HCl dan NH3 (ikatan kovalen dan ikatan kovalen)
C. NH3 dan SO3 (ikatan kovalen dan ikatan kovalen koordinasi)
D. SO3 dan KOH (ikatan kovalen koordinasi dan ikatan ion)
E. KOH dan NaCl (ikatan ion dan ikatan ion)
Soal No. 4
Di antara senyawa di bawah ini yang merupakan senyawa yang berikatan ion adalah ….
A. NH3
B. CH4
C. NaH
D. CO2
E. PCl3
Jawaban: C
Pembahasan:
Ikatan ion terjadi karena adanya serah terima elektron. Meskipun Na dan H berada pada satu golongan, namun unsur Na melepaskan 1 elektron dan unsur H menerima 1 elektron. Sehingga terjadi serah terima elektron.
1H = 1 (kekurangan satu elektron)
11Na = 2 8 1 (kelebihan satu elektron)
Na+ + H– → NaH
Soal No. 5
Empat unsur A, B, C, D masing-masing mempunyai nomor atom 16, 17, 18, 19. Pasangan yang dapat membentuk ikatan ion adalah ….
A. A dan B
B. A dan C
C. B dan C
D. B dan D
E. C dan D
Jawaban: D
Pembahasan:
Kita tuliskan dulu konfigurasi elektronnya, supaya kita tahu mana yang melepaskan elektron dan mana yang menerima elektron.
16A = 2 8 6 (kekurangan dua elektron)
17B = 2 8 7 (kekurangan satu elektron)
18C = 2 8 8 (stabil)
19D = 2 8 8 1 (kelebihan satu elektron)
Jadi, yang dapat membentuk ikatan ion adalah A dan D serta B dan D.
B. Soal Essay
Soal No. 6
Jelaskan pengertian ikatan ion!
Pembahasan:
Ikatan ion adalah ikatan kimia yang terjadi karena adanya gaya tarik-menarik elektrostatis antara ion positif dengan ion negatif.
Soal No. 7
Unsur-unsur logam bila bersenyawa dengan unsur-unsur non-logam mempunyai kecenderungan untuk membentuk ikatan ion. Bagaimana pendapat Anda tentang pernyatan ini? Jelaskan.
Pembahasan:
Ikatan ion terjadi antara atom-atom yang mempunyai energi ionisasi rendah dengan atom-atom yang mempunyai afinitas elektron yang besar. Unsur-unsur logam umumnya mempunyai energi ionisasi yang rendah sedangkan unsur-unsur non-logam mempunyai afinitas elektron yang tinggi. Oleh karena itu, ikatan ion dapat terjadi antara unsur-unsur logam dengan unsur-unsur non-logam.
Soal No. 8
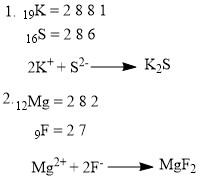
Jelaskan terjadinya ikatan ion pada senyawa berikut.
- K2S (nomor atom K = 19 dan S = 16)
- MgF2 (nomor atom Mg = 12 dan F = 9)
Pembahasan:
Soal No. 9
Mengapa kristal senyawa ion dapat pecah jika dikenai tekanan (dipukul)?
Pembahasan:
Apabila senyawa ion dipukul, akan terjadi pergeseran posisi ion positif dan negatif, dari yang semula berselang-seling menjadi berhadapan langsung. Hal ini menyebabkan ion positif bertemu muka ion positif dan menjadi gaya tolak-menolak. Inilah yang menyebabkan kristal senyawa ion dapat pecah jika dikenai tekanan (dipukul)
Soal No. 10
Mengapa ikatan ion lebih kuat dibandingkan dengan ikatan kovalen? Jelaskan secara singkat.
Pembahasan:
Ikatan ion terjadi karena adanya gaya tarik-menarik elektrostatis antara ion positif dengan ion negatif sedangkan ikatan kovalen terjadi karena pemakaian bersama pasangan elektron.