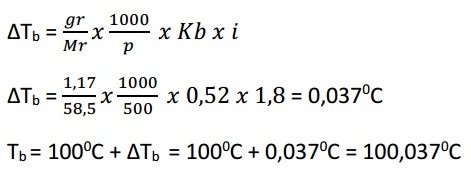Soal Pilihan Ganda dan Pembahasan Sifat Koligatif Larutan No. 6-10
Soal No. 6
Cermati peristiwa kimia berikut!
- Penyulingan minyak bumi
- Penggunaan obat tetes mata
Kedua peristiwa tersebut secara berturu-turut merupakan contoh sifat koligatif ….
A. Kenaikan titik didih dan tekanan osmotik
B. Penurunan titik beku dan kenaikan titik didih
C. Tekanan osmotic dan penurunan tekanan uap
D. Kenaikan titik didih dan penurunan tekanan uap
E. Penurunan tekanan uap dan penurunan titik beku
Jawaban: A
Pembahasan:
- Penyulingan minyak bumi menggunakan prinsip destilasi, yaitu pemisahan berdasarkan perbedaan titik didih.
- Cairan obat tetes mata yang memilki sifat hipotonik akan mengalir melewati membran semipermeable pada mata dan masuk ke cairan dalam mata.
Soal No. 7
Suatu larutan nonelektrolit membeku pada suhu -0,3720 Jika Kf air = 1,860C/mol dan Kb air = 0,520C/mol, kenaikan titik didih larutan tersebut sebesar ….
A. 0,0530C
B. 0,1040C
C. 0,3720C
D. 0,5200C
E. 1,0400C
Jawaban: B
Pembahasan:
Diketahui:
Tf larutan = – 0,3720C
Kf air = 1,860C/mol
Kb air = 0,520C/mol
Ditanyakan: ∆Tb ….?
Jawaban:
Tf larutan = Tf pelarut – ∆Tf
-0,372 = 0 – ∆Tf
∆Tf = 0,3720C
∆Tf = m x Kf
0,3720C = m x 1,860C/mol
m = 0,372/1,86 = 0,2 molal
∆Tb = m x Kb = 0,2 x 0,52 = 0,1040C
Soal No. 8
Perhatikan tabel berikut!
| Larutan Nonelektrolit | Jumlah Mol Partikel Zat Terlarut | Jumlah Mol Partikel Zat Pelarut |
| K | 4 | 6 |
| L | 6 | 5 |
| M | 2 | 7 |
| N | 5 | 4 |
| O | 2 | 5 |
Larutan yang mempunyai tekanan uap paling rendah ….
A. K
B. L
C. M
D. N
E. O
Jawaban: D
Pembahasan:
Tekanan uap larutan nonelektrolit sebanding dengan fraksi zat mol pelarut. Semakin besar fraksi mol pelarut, semakin besar tekanan uapnya.
Larutan K
Xp = np / (np + nt)
Xp = 6/(6+4) = 0,6
Larutan L
Xp = np / (np + nt)
Xp = 5/(5+6) = 0,45
Larutan M
Xp = np / (np + nt)
Xp = 7/(7+2) = 0,78
Larutan N
Xp = np / (np + nt)
Xp = 4/(4+5) = 0,44
Larutan O
Xp = np / (np + nt)
Xp = 5/(5+2) = 0,72
Soal No. 9
Sebanyak 4,9 gram H2SO4 dilarutkan dalam 180 gram air. Jika H2SO4 terionisasi sempurna dan tekanan uap air pada suhu ruang sebesar 30 mmHg, tekanan uap larutan pada suhu tersebut sebesar …. (Ar: H = 1; S = 32; O = 16)
A. 29,85 mmHg
B. 29,70 mmHg
C. 29,56 mmHg
D. 29,35 mmHg
E. 29,28 mmHg
Jawaban: C
Pembahasan:
Larutan H2SO4 terionisasi sempurna (α = 1)
H2SO4 → 2H+ + SO42-
n = 3
i = 1 + (n-1) α = 1 + (3 – 1) 1 = 3
n H2SO4 = gr/Mr = 4,9/968 = 0,05 mol
n H2O = gr/Mr = 180/18 = 10 mol
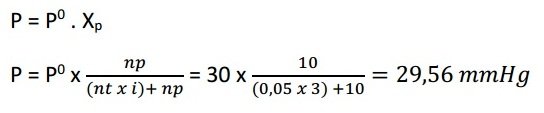
Soal No. 10
Sebanyak 1,17 gram NaCl dilarutkan dalam air hingga volumenya 500 mL. Jika NaCl terionisasi 80%, titik didih larutan tersebut adalah ….
(Ar: Na = 23; Cl = 35,5; Kb = 0,520C/m)
A. 100,0210C
B. 100,0370C
C. 100,0420C
D. 100,0740C
E. 100,1160C
Jawaban: B
Pembahasan:
Diketahui:
gr NaCl = 1,17 gr
Mr NaCl = 58,5
V = 500 mL
Α = 80% = 0,8
Kb = 0,520C/m
Ditanyakan: Tb …?
Jawaban:
NaCl → Na+ + Cl–
n = 2
i = 1 + (n -1) α
i = 1 + (2 – 1) 0,8 = 1,8