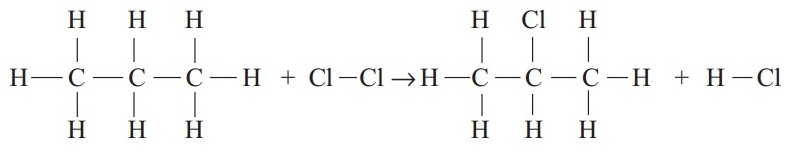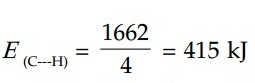Energi ikatan rata-rata adalah energi yang diperlukan untuk memutuskan 1 mol ikatan dari suatu molekul dalam wujud gas. Energi ikatan dinyatakan dalam satuan kJ/mol atau kkal/mol. Lebih mudahnya perhatikan contoh soal energi ikatan beserta jawabannya berikut ini.
Soal Pilihan Ganda Energi Ikatan
Soal No. 1
Diketahui energi ikatan rata-rata:
C = C : 146 kkal/mol
C – C : 83 kkal/mol
C – H : 99 kkal/mol
C – Cl : 79 kkal/mol
H – Cl : 103 kkal/mol
Maka perubahan entalpi pada reaksi:
C2H4(g) + HCl(g) → C2H4Cl(g) adalah ….
A. -510 kkal
B. +510 kkal
C. +72 kkal
D. -42 kkal
E. -12 kkal
Jawaban: E
Pembahasan:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = {(4 x C – H) + C = C + H – Cl} – {(5 x C – H) + C – C + C – Cl}
∆Hreaksi = {(4 x 99) + 146 + 103} – {(5 x 99) + 83 + 79}
∆Hreaksi = 645 – 657 = – 12 kkal
Soal No. 2
Diketahui energi ikatan:
C – F : 439 kJ/mol
C – Cl : 330 kJ/mol
F – F : 159 kJ/mol
Cl – Cl : 243 kJ/mol
Panas reaksi untuk:
CF2Cl2 + F2 → CF4 + Cl2
adalah … kJ
A. +136
B. +302
C. -302
D. +622
E. -622
Jawaban: C
Pembahasan:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = {(2 x C – F) + (2 x C – l) + F – F} – {(4 x C – F) + Cl – Cl}
∆Hreaksi = {(2 x 439) + (2 x 330) + 159} – {(4 x 439) + 243}
∆Hreaksi = (878 + 660 + 159) – (1756 + 243)
∆Hreaksi = 1697 – 1999 = -302 kJ
Soal No. 3
Diketahui data energi ikatan kJ/mol rata-rata:
H – H : 436
Cl – Cl : 242
H – Cl : 432
Kalor yang diperlukan untuk menguraikan 146 gram HCl menjadi unsur-unsurnya sebesar ….
A. 494 kJ
B. 372 kJ
C. 247 kJ
D. 184 kJ
E. 93 kJ
Jawaban: B
Pembahasan:
Persamaan reaksi penguraian HCl:
2HCl → H2 + Cl2
gr HCl = 146 gram
Mr HCl = 36,5 gr/mol
Jumlah mol = gr/Mr = 146/36,5 = 4 mol
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (2 x H – Cl) – (H – H + Cl – Cl)
∆Hreaksi = (2 x 432) – (436 + 242)
∆Hreaksi = 864 – 678 = 186 kJ [untuk 2 mol HCl]
∆Hreaksi = 186 kJ : 2 = 93 kJ [untuk 1 mol HCl]
∆Hreaksi untuk 146 gram HCl = 4 x 93 kJ = 372 kJ
Soal No. 4
Jika energi ikatan rata-rata sebagai berikut.
C = C : 146 kkal
C – C : 83 kkal
C – H : 99 kkal
C – Cl : 79 kkal
H – Cl : 103 kkal
Maka perubahan entalpi pada adisi 117,6 gram etena dengan asam klorida menurut persamaan reaksi:
H2C = CH2 + HCl → H3C – CH2 – Cl
sebesar ….
A. -2142 kJ/mol
B. -305,76 kJ/mol
C. -50,4 kJ/mol
D. +50,4 kJ/mol
E. 21,42 kJ/mol
Jawaban: C
Pembahasan:
Persamaan reaksi adisi etena dengan HCl:
H2C = CH2 + HCl → H3C – CH2 – Cl
gr etena= 117,6 gram
Mr etena = 28 gr/mol
Jumlah mol = gr/Mr = 117,6/28 = 4,2 mol
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (C = C + (4 x C – H )+ H – Cl) – ( C – C + (5 x C – H) + C – Cl)
∆Hreaksi = (C = C + H – Cl) – ( C – C + C –H + C – Cl)
∆Hreaksi = (146 + 103) – (83 + 99 + 79)
∆Hreaksi = 249 – 261= –12kkal [untuk 1 mol etena]
∆Hreaksi = –12kkal x 4,2 = – 50,4 kkal [untuk 4,2 mol etena]
Soal No. 5
Diketahui energi ikatan sebagai berikut:
C – H : 414 kJ/mol
C = O : 799 kJ/mol
O – H : 464 kJ/mol
O = O : 498 kJ/mol
Jika ∆H pembakaran C2H2 = -1,26 x 103 kJ/mol, maka energi ikatan C≡C adalah ….
A. 841 kJ
B. 807 kJ
C. 309 kJ
D. 260 kJ
E. 540 kJ
Jawaban: B
Pembahasan:
Persamaan reaksi pembakaran C2H2:
C2H2 + 2 ½ O2 → 2CO2 + H2O
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (C≡C + (2 x C – H) + (2 ½ x O=O)) – ((2 x C=O) + (2 x O – H))
-1,26 x 103 = (C≡C + (2 x 414) + (2 ½ x 498)) – ((2 x 799) + (2 x 464))
-1260 = (C≡C + 828 + 1245) – (1598 + 928)
-1260 = C≡C + 2073 – 2526
C≡C = -1260 + 453= -807 kJ
Soal No. 6
Diketahui energi ikatan:
C – C : 348 kJ/mol
H – Cl : 431 kJ/mol
C – H : 423 kJ/mol
Cl – Cl : 242 kJ/mol
C – Cl : 328 kJ/mol
Besarnya ∆H pada reaksi:
adalah ….
A. +94 kJ
B. +81 kJ
C. -81 kJ
D. -94 kJ
E. -208 kJ
Jawaban: D
Pembahasan:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = ((2 x C – C) + (8 x C – H) + (Cl – Cl)) – ((2 x C – C) + (7 x C – H) + (C – Cl) + (H – Cl))
∆Hreaksi = (C – H) + Cl – Cl) – (C – Cl + H – Cl)
∆Hreaksi = (423 + 242) – (328+ 431)
∆Hreaksi = 665 – 759 = -94 kJ
Soal No. 7
Diketahui energi ikatan N≡N : 163 kJ/mol dan H – H : 436 kJ/mol. Pada reaksi:
½ N2(g) + 3/2 H2(g) → NH3(g) ∆H = -438 kJ/mol
Energi ikatan rata-rata N – H adalah ….
A. 1.173,5 kJ
B. 735,5 kJ
C. 391 kJ
D. 195,5 kJ
E. 130 kJ
Jawaban: C
Pembahasan:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (½ x N≡N) + (3/2 x H – H) – (3 x N – H)
-438 = (½ x 163) + (3/2 x 436) – ( 3 x N – H)
-438 = 81,5 + 654 – ( 3 x N – H)
3 x N – H = 438 + 81,5 + 654
N – H = 1.173,5/3 = 391,16 kJ
Soal No. 8
Diketahui data energi ikat beberapa ikatan sebagai berikut
- C≡C: +839 kJ.mol-1
- C-C: +348 kJ.mol-1
- C-H: +413 kJ.mol-1
- H-H: +436 kJ.mol-1
Nilai ∆H untuk reaksi tersebut adalah …
A. -2000 kJ.mol-1
B. -1652 kJ.mol-1
C. -826 kJ.mol-1
D. -348 kJ.mol-1
E. -289 kJ.mol-1
Jawaban: E
Pembahasan:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (C≡C + C – C + (4 x C – H) + (2 x H – H)) – ((2 x C – C) + (8 x C – H))
∆Hreaksi = (C≡C + (2 x H – H)) – (C – C + (4 x C – H))
∆Hreaksi = (839 + (2 x 436)) – (348+ (4 x 413))
∆Hreaksi = 1711 – 2000 = -289 kJ/mol
Soal No. 9
Diketahui energi ikatan:
N – H : 315 kJ/mol
N ≡ N : 945 kJ/mol
H – H : 433 kJ/mol
Kalor penguraian NH3 menurut reaksi
2NH3 → N2 + H2
adalah …. kJ/mol.
A. -97
B. +97
C. -194
D. +194
E. -138
Jawaban: E
Pembahasan:
Reaksi Setara:
2NH3 → N2 + 3H2
∆HR = ∑E reaktan – ∑E produk
∆HR = (2 x 3 x N – H) – (N≡N + (3 x H – H))
∆HR = (6 x 351) – (945 + (3 x 433))
∆HR = 2106 – 1378 = -138 kJ/mol
Soal No. 10
Diketahui entalpi reaksi penguraian HBr adalah -36,2 kJ/mol. Energi ikatan rata-rata H – H dan Br – Br masing-masing 431 kJ/mol dan 188 kJ/mol, maka energi ikatan H – Br adalah …. kJ/mol.
A. -582,8
B. -291,4
C. +136,65
D. +291,4
E. +582,8
Jawaban: D
Pembahasan:
Reaksi penguraian HBr:
2HBr → H2 + Br2
∆Hr = ∑E Reaktan – ∑E Produk
-36,2 = 2(H – Br) – (H – H + Br – Br)
-36,2 = 2(H – Br) – (431 + 188)
2(H – Br) = -36,2 + 619
2(H – Br) = 582,8
H – Br = 582,8/2 = +291,4 kJ/mol
Soal Essay Energi Ikatan
Soal No. 1
Bila diketahui energi ikatan rata-rata N – H pada NH3 = 391 kJ/mol, H – H = 435 kJ/mol, energi ikatan rata-rata rangkap tiga N = 946 kJ/mol, maka entalpi pembentukan gas NH3 adalah ….
Jawaban:
Persamaan reaksi pembentukan NH3:
½ N2 + 3/2 H2 → NH3
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = (½ x N≡N) + (3/2 x H – H) – (3 x N – H)
∆Hreaksi = (½ x 946 ) + (3/2 x 435) – ( 3 x 391)
∆Hreaksi = 473 + 652,5 – 1173 = –47,5 kJ/mol
Soal No. 2
Hitung energi ikatan atom karbon dan hidrogen dalam CH4, jika diketahui reaksi pengatoman sebagai berikut:
CH4(g) → C(g) + 4H(g) ∆H = +1662 kJ
Jawaban:
Soal No. 3
Dengan menggunakan data energi ikatan rata-rata, hitung entalpi dari reaksi
C2H4 + H2 → C2H6
Jawaban:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = {(C = C) + (4 x C – H) + (H – H)} – {(C – C) + (6 x C – H)}
∆Hreaksi = {611 + (4 x 414) + 436} – {348 + (6 x 414)
∆Hreaksi = 2703 – 2832 = – 129 kJ/mol
Soal No. 4
Gunakan data energi ikatan untuk menghitung ∆Hreaksi dari reaksi berikut ini.
C2H2(g) + C2H6(g) → 2C2H4(g)
Jawaban:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = {(C = C) + (2 x C – H) + (C – C) + (6 x C – H)} – {(2 x C – C) + (8 x C – H)}
∆Hreaksi = {611+ (2 x 414) + 348 + (6 x 411)} – {(2 x 348) + (8 x 414) }
∆Hreaksi = 1439 + 2814 – 4008 = – 245 kJ/mol
Soal No. 5
Diketahui reaksi sebagai berikut:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g) ∆H = -100,4 kJ
Energi ikatan rata-rata dari
C – Cl : 330 kJ/mol
Cl – Cl : 243 kJ/mol
H – Cl : 432 kJ/mol
Tentukan energi ikatan disosiasi C – H.
Jawaban:
∆Hreaksi = ∑E reaktan – ∑E Produk
∆Hreaksi = {(4 x C – H) + Cl – Cl} – {(3 x C – H) + C – Cl + H – Cl }
∆Hreaksi = (C – H + Cl – Cl) – (C – Cl + H – Cl)
-100,4 = C – H + 243 – 330 – 432
-100,4 = C – H – 519
C – H = -100,4 + 519 = 418,6 kJ/mol